Фактор риска болезни Альцгеймера нарушает целостность гематоэнцефалического барьера
Генетическая вариация APOE4 ассоциирована с повышенным риском развития болезни Альцгеймера. Обнаружилось, что эта вариация также предрасполагает к развитию дефектов гематоэнцефалического барьера, приводящих к снижению когнитивных способностей.
Макото Исии, Константино Ядекола
Оригинал на английском: Risk factor for Alzheimer’s disease breaks the blood–brain barrier (Nature.com, April 2020)
Наиболее известными патологическими отклонениями в мозге пациентов при болезни Альцгеймера являются скопления бета-амилоидного белка и тау-белков, свернувшихся в неправильной пространственной конфигурации. Вместе с тем растет понимание того, что картина не ограничивается лишь бета-амилоидом и тау-белками, поскольку на ранних стадиях данного нейродегенеративного заболевания выявляются изменения в структуре гематоэнцефалического барьера (ГЭБ). Было установлено, что степень поражения ГЭБ у пациентов коррелирует со степенью когнитивных нарушений, но причина поражения ГЭБ оставалась загадкой. В статье, опубликованной группой Montagne et al. в журнале Nature, приводятся данные, указывающие на связь аполипопротеина E4, представляющего собой самый важный генетический фактор развития болезни Альцгеймера, с повреждением ГЭБ.
Продукт гена APOE – белок аполипопротеин E, являющийся важным переносчиком липидов в тканях мозга. Три основных аллельных варианта гена APOE называются APOE2, APOE3 и APOE4. Подобно большинству других генов, ген APOE представлен в геноме человека двумя копиями, которые могут не совпадать по вариантам. По сравнению с более распространенным вариантом APOE3, вариант APOE4 существенно повышает риск развития болезни Альцгеймера – при наличии одной копии он повышен до 4 раз, при наличии двух копий до 15 раз. У тех носителей варианта APOE4, у которых в итоге развивается болезнь Альцгеймера, симптомы появляются раньше, чем у пациентов, у которых болезнь развилась при отсутствии данного варианта.
При исследовании образцов спинномозговой жидкости (циркулирующей в пространствах, окружающих спинной и головной мозг), собранных у носителей варианта APOE4, не страдавших когнитивными нарушениями на момент анализа, но заболевших впоследствии болезнью Альцгеймера, обнаруживаются белки плазмы крови. Эти белки предположительно проникают туда сквозь ГЭБ, что свидетельствует о том, что целостность барьера нарушается до того, как у человека начинают ухудшаться мыслительные способности. Данные, полученные при исследовании мышиных моделей заболевания и при анализе тканей мозга пациентов, скончавшихся от болезни Альцгеймера, указывают на то, что причиной повреждения ГЭБ может являться деградация перицитов – клеток, выстилающих стенки капилляров, пронизывающих мозг. В норме эти клетки защищают ГЭБ, предотвращая разрушение контактов между клетками капиллярного эндотелия.
Оставалось загадкой, играет ли ApoE4 роль в развитии ранней дисфункции ГЭБ при болезни Альцгеймера, будь то самостоятельно либо в сочетании с амилоидом-бета и тау-белком. Аксель Монтень (Axel Montagne) с соавторами взялись заполнить этот пробел. Исследователи использовали метод под названием "МРТ с динамическим контрастным усилением", чтобы оценить проницаемость ГЭБ у людей без когнитивных нарушений и лиц с небольшими нарушениями (считающимися предвестниками болезни Альцгеймера), распределенных по группам в зависимости от вариаций гена APOE. Они обнаружили, что у носителей одной либо двух копий варианта APOE4, несмотря на сохранную когнитивную сферу, отмечалась проницаемость ГЭБ в двух областях мозга, ответственных за работу памяти и мыслительные функции – в гиппокампе и в парагиппокампальной извилине. Проницаемость ГЭБ была сильнее у носителей варианта APOE4, демонстрировавших слабые когнитивные нарушения.
Примечательно то, что эти нарушения были отмечены ранее, нежели потеря вещества в гиппокампе и парагиппокампальной извилине – это говорит в поддержку идеи о том, что потеря барьерной функции ГЭБ – ранняя стадия нейродегенерации. Согласно данным, полученным при анализе образцов спинномозговой жидкости и исследовании мозга с помощью позитронно-эмиссионной томографии, нарушение целостности ГЭБ не было ассоциировано с накоплением бета-амилоида и тау-белка. Монтень с коллегами обнаружили, что у когнитивно сохранных носителей APOE3, в отличие от носителей APOE4, целостность ГЭБ нарушена не была. В то же время у носителей APOE3 с когнитивными нарушениями целостность ГЭБ была нарушена – но не настолько сильно, как у носителей APOE4 с аналогичной выраженностью нарушений мышления.
Следующим шагом Монтеня и коллег было изучение вопроса о том, связано ли нарушение целостности ГЭБ у носителей APOE4 с деградацией перицитов. Они обнаружили, что уровень биомаркера поражения перицитов – растворимой формы белка sPDGFRβ (рецептора тромбоцитарного фактора роста-бета) в спинномозговой жидкости носителей APOE4 выше, чем в спинномозговой жидкости носителей APOE3. Повышенные уровни данного белка в организме носителей APOE4 оказались ассоциированы с проницаемостью ГЭБ и нарушениями в когнитивной сфере. Корреляции повышенных уровней с sPDGFRβ с изменением концентрации бета-амилоида и тау-белка отмечено не было.
Затем авторы взялись изучить, какие именно взаимодействия могут приводить к повреждению перицитов. Предметом их внимания стали циклофилин A (CypA) и матриксная металлопротеиназа-9 (MMP9) – два белка, участвующих в воспалительной цепочке, предположительно связанной с развитием повреждений перицитов и ГЭБ под воздействием APOE4. Уровни CypA и MMP9 в спинномозговой жидкости оказались повышены у носителей APOE4 со слабовыраженным нарушением когнитивной функции по сравнению с когнитивно сохранными носителями APOE4, а также по сравнению с носителями APOE3 со сравнимым нарушением когнитивной функции. Это изменение также не было связано с повышением уровней бета-амилоида либо тау-белка.
Наконец, исследователи сгенерировали перициты in vivo из индуцированных плюрипотентных стволовых клеток, экспрессирующих APOE3 либо APOE4. Они обнаружили, что перициты, экспрессирующие APOE4, производят гораздо больше CypA и MMP9, чем перициты, экспрессирующие APOE3. ApoE4 (но не ApoE3), секретируемый перицитами, активирует сигнальный путь CypA-MMP9 в близлежащих перицитах – таким образом собственная активность клеток приводит к их гибели. ApoE4 также способен активировать путь CypA-MMP9 в эндотелиальных клетках, которые демонстрируют чувствительность к негативным последствиям активности APOE4. Таким образом, возможно, что как повреждение перицитов, так и повреждение клеток эндотелия могут нарушать герметичность ГЭБ (рис. 1).
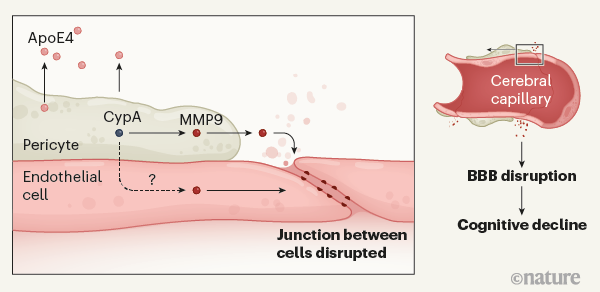
Рисунок 1. | Генетический вариант APOE4 и болезнь Альцгеймера. Риск развития болезни Альцгеймера повышен у носителей варианта APOE4. Согласно данным, представленным группой Montagne et al., белок ApoE4 секретируется перицитами, прилегающими к клеткам эндотелия церебральных капилляров, образующим гематоэнцефалический барьер (ГЭБ). Секретированный ApoE4 активирует выработку циклофилина A (CypA) перицитами. Это, в свою очередь, задействует сигнальную цепочку, по ходу которой происходит активация производства матриксной металлопротеиназы 9 (MMP9, воспалительного белка) как в перицитах, так и, возможно, в клетках эндотелия. Результатом является повреждение плотных контактов между эпителиальными клетками, что вызывает протечку ГЭБ в областях мозга, связанных с процессами обучения и работой памяти. Повреждения ГЭБ ассоциированы с нарушениями в когнитивной сфере, хотя механизмы, которые могут связывать эти проявления, до сих пор неясны.
Полученные данные позволяют взглянуть на APOE4 по-новому и бросают вызов привычному представлению о том, что данный генетический вариант способствует развитию болезни Альцгеймера лишь своей способностью стимулировать накопление бета-амилоида и тау-белка. Теперь представляется, что предрасположенность носителей APOE4 к развитию болезни Альцгеймера можно объяснить дисфункцией ГЭБ. Результаты, полученные исследователями, также могут объяснить, почему после инсульта либо черепно-мозговой травмы у носителей APOE4 наблюдаются более серьезные последствия, чем у носителей других вариантов гена APOE. Вместе с тем по мере прогрессирования болезни Альцгеймера APOE4 также может замедлять процесс очищения тканей от бета-амилоида и тау-белка, что должно способствовать развитию когнитивных нарушений.
Еще более поразительным оказалось то, что ранние когнитивные нарушения у носителей APOE4 и APOE3 развиваются по разным причинам. Данные, представленные группой Монтеня, позволяют предположить, что у носителей APOE3, самого распространенного варианта гена, снижение мыслительных способностей происходит не из-за активации сигнального пути CypA и не из-за повреждения перицитов. Вместе с тем остается загадкой, не способствуют ли развитию когнитивных отклонений у носителей APOE3 факторы, не связанные с работой перицитов, но также нарушающие целостность ГЭБ (например, повреждение эндотелиальных клеток бета-амилоидом). Неясна и роль ГЭБ в развитии болезни у носителей APOE2, не участвовавших в исследовании. У людей с вариантом APOE2 риск развития болезни Альцгеймера снижен по сравнению с носителями других вариантов APOE, но это вряд ли связано с повышенной надежностью гематоэнцефалического барьера, поскольку APOE2 ассоциирован с повышенным риском развития микроскопических кровотечений, что говорит о хрупкости сосудов.
Точка в вопросе о том, вызывают ли повреждения ГЭБ когнитивные отклонения и если вызывают, то как именно, еще не поставлена. Являются ли они причиной либо следствием патологических процессов при заболевании? В исследованиях на мышах было отмечено губительное воздействие белков крови, таких как фибриноген, на межнейронные связи, однако на данный момент еще не получено доказательств патогенного воздействия данных белков на мозг человека.
Пусть не на все вопросы даны ответы, результаты, представленные группой Montagne et al., расширили наше понимание связи между APOE4 и развитием когнитивных нарушений. Авторы также продемонстрировали, что разные варианты APOE способствуют развитию болезни разными способами. Накопление знаний о механизмах, связывающих различные генетические вариации с патологическими процессами, может оказаться крайне полезным для разработки персонализированных схем терапии такого распространенного и неизлечимого заболевания, как болезнь Альцгеймера.
Научная публикация: APOE4 leads to blood–brain barrier dysfunction predicting cognitive decline (Montagne et al., Nature, 2020)
Автор новости: Артем Тимеев (переводы фармакологических, биотехнологических текстов с русского на английский и с английского на русский; email: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.).
10 мая 2020 года.