Получены данные в поддержку гипотезы, связывающей нарушения процессов синаптического прунинга с развитием шизофрении
В наши дни для нейробиологов не является откровением тот факт, что процесс развития лобной доли мозга – области, отвечающей за многие сложные поведенческие реакции – продолжается и в подростковом, и в раннем взрослом возрасте. Однако в 1983 году идея о столь длительном созревании мозга была, по словам психиатра Ирвина Файнберга, "в новинку". В тот год он опубликовал свою гипотезу о том, что шизофрения возникает из-за сбоев в одном из процессов развития подросткового мозга. Благодаря геномным исследованиям мы наконец-то начинаем узнавать о возможных механизмах этого патологического процесса.
Одним из пионеров в данной области стал нейробиолог Питер Гуттенлохер, осуществивший в 1979 году важное исследование связей мозга. Гуттенлохер подсчитал количество межнейронных соединений (синапсов) в срезах лобной доли мозга, взятых у лиц разных возрастов – от 0 до 90 лет, с помощью электронного микроскопа. Результаты оказались неожиданными – они свидетельствовали о значительном уменьшении числа синапсов во взрослом возрасте по сравнению с ранним детством. Файнберг в то время исследовал активность мозга во сне, пытаясь понять, как она изменяется под воздействием процессов взросления и старения. Изменения, описанные Гуттенлохером, поразительно напоминали одно явление, которое Файнберг наблюдал при электроэнцефалографическом (ЭЭГ) исследовании лиц на втором десятке лет жизни. В этот период происходит резкое снижение амплитуды электрических колебаний мозга во время фаз сна, не сопровождающихся сновидениями.
Помня о том, что симптомы шизофрении обычно возникают в конце второй – начале третьей декады жизни, Файнберг выдвинул смелую гипотезу, связывающую эти три явления. Согласно предложенной им гипотезе, естественные изменения численности либо пространственной структуры синапсов, происходящие в подростковом мозге в соответствии с программами синаптического прунинга, снижают амплитуду волн мозга во сне. Сбои в этих программах (ведущие к недостаточному либо избыточному прунингу) вызывают симптомы шизофрении либо способствуют их появлению.
Вопрос взаимосвязи функций мозга с его архитектурой занимал Файнберга с начала 1960-х годов. Он вспоминает, как однажды, находясь в офисе своего ментора Жана Пиаже, создателя теории когнитивного развития, он "высказал предположение о том, что когнитивное развитие может быть отчасти связано с биологическими изменениями в мозге. Реакции не последовало – Пиаже продолжил беседу, словно не заметив моей реплики". Двадцать лет спустя нейробиологи в той же манере отреагировали на его гипотезу о взаимосвязи прунинга и шизофрении – в интервью, данном год назад, Файнберг вспомнил, что их реакция была "абсолютно безразличной".
Следует отметить один серьезный изъян в исследовании Гуттенлохера, на протяжении долгих лет препятствовавший признанию полученных им результатов. Из-за сложностей с получением образцов и трудоемкости самого процесса анализа лишь один из объектов его исследования был подростком. Несмотря на то, что наличие схожего процесса постнатального синаптического прунинга было продемонстрировано в исследованиях мозга приматов (см. обзор в публикации №5), лишь в 1997 году ученым удалось получить образцы мозга нескольких лиц подросткового возраста и представить дополнительные подтверждения наличия этого процесса у человека. И, наконец, в 2011 году были опубликованы результаты исследования пяти образцов мозга лиц, скончавшихся в возрасте от 10 до 22 лет.
Параллельно с исследованиями, направленными на восполнение данного пробела в нашем понимании нормальных процессов развития мозга, по крайней мере две группы ученых стремились обнаружить признаки нарушения синаптического прунинга в мозге пациентов с шизофренией, и на рубеже веков их попытки увенчались успехом. Использовав методику окрашивания тканей, позволяющую подсчитать число нейрональных структур (дендритных шипиков), служащих входящими синаптическими терминалами определенных аксонов, ученые показали, что плотность синапсов в областях мозга, отвечающих за высшие мыслительные функции, у пациентов ниже, чем у здоровых людей.
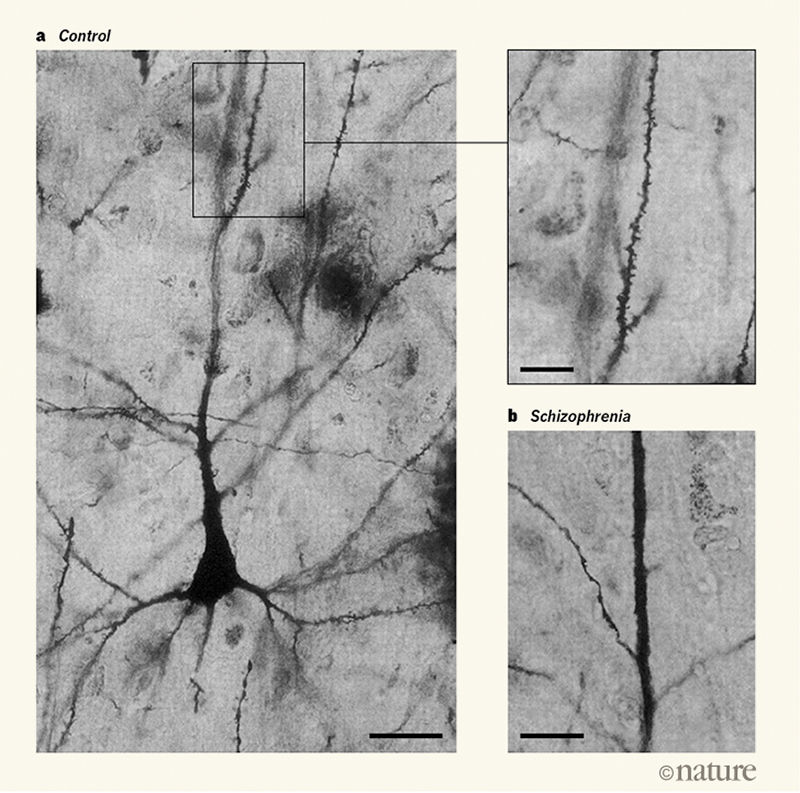
Илл. 1. Микроснимки нейронов мозга человека. а) Нейрон в образце мозга, не пораженного шизофренией, усыпан дендритными шипиками (см. увеличенный фрагмент изображения). Численность шипиков отражает число входящих синаптических соединений, образуемых нейроном с другими нейронами (не показаны на снимке). Длина масштабной метки: 30 мкм (на увеличенном фрагменте: 20 мкм). б) В тканях мозга пациента с шизофренией число шипиков, а следовательно и синаптических соединений, снижено. Длина метки: 15 мкм (источник: публикация №8).
В последующие годы благодаря появлению неинвазивных технологий визуализации головного мозга ученым стало легче исследовать как нормальное нейрональное развитие, так и патологические процессы, связанные с возникновением психических заболеваний. В одном нейровизуализационном исследовании было продемонстрировано, что объем серого вещества (содержащего наибольшее количество синаптических соединений) в височной и лобной долях сначала повышается в раннем детском возрасте, а затем снижается в подростковом. Такая картина изменений согласуется с нашими знаниями о прунинге нейрональных отростков и синапсов в подростковом возрасте. Другое исследование было направлено на оценку скорости потери серого вещества в лобной доле у лиц, отнесенных к "группе риска". Наибольшая скорость потери вещества была отмечена у тех, кто впоследствии пережил наступление психоза. Так постепенно накапливались данные в поддержку гипотезы Файнберга.
Благодаря происходящей в наше время геномной революции гипотеза получила новые подтверждения. Исследования десятков тысяч пациентов, страдающих шизофренией, позволили выявить генные вариации, ассоциированные с повышенным риском развития заболевания. Среди кандидатов на роль в развитии заболевания с большим отрывом лидирует одна из областей шестой хромосомы, содержащая гены, связанные с иммунными процессами. Этих генов – несколько сотен, что затрудняет поиски конкретных генов риска. Благодаря сравнительному анализу образцов мозга и ДНК здоровых людей и пациентов, проведенному в 2016 году, ученые смогли обнаружить вариацию одного из генов данной области, частично ответственную за повышенный риск шизофрении. Данный ген кодирует белок C4 – "4-й компонент системы комплемента".
Авторы установили, что у носителей разных вариаций данного гена вырабатывается разное количество белка C4, а повышенная экспрессия белка C4 коррелирует с повышенным риском развития шизофрении. Независимые исследования, проведенные нашей и другими группами на мышах, показали, что иммунный сигнальный каскад, в котором участвует белок C4 ("сигнальный каскад системы комплемента") побуждает иммунные клетки отсекать синапсы в процессе развития мозга. В настоящее время ученые активно заняты исследованием того, как данный механизм синаптического прунинга связан с риском развития шизофрении, возрастом начала заболевания, и как он соотносится с нормальными изменениями активности мозга во сне у подростков. Эти вопросы представляют большой научный интерес. Остаются без ответа вопросы о том, как человеческий организм "решает", какие синапсы должны подпасть под влияние белка C4 – где и когда должна быть разрушена синаптическая связь. Также предстоит выяснить, обладают ли некоторые синапсы или нейронные цепочки устойчивостью к прунингу, вызываемому системой комплемента, а также о связи этих еще не исследованных взаимодействий с конкретными симптомами заболевания.
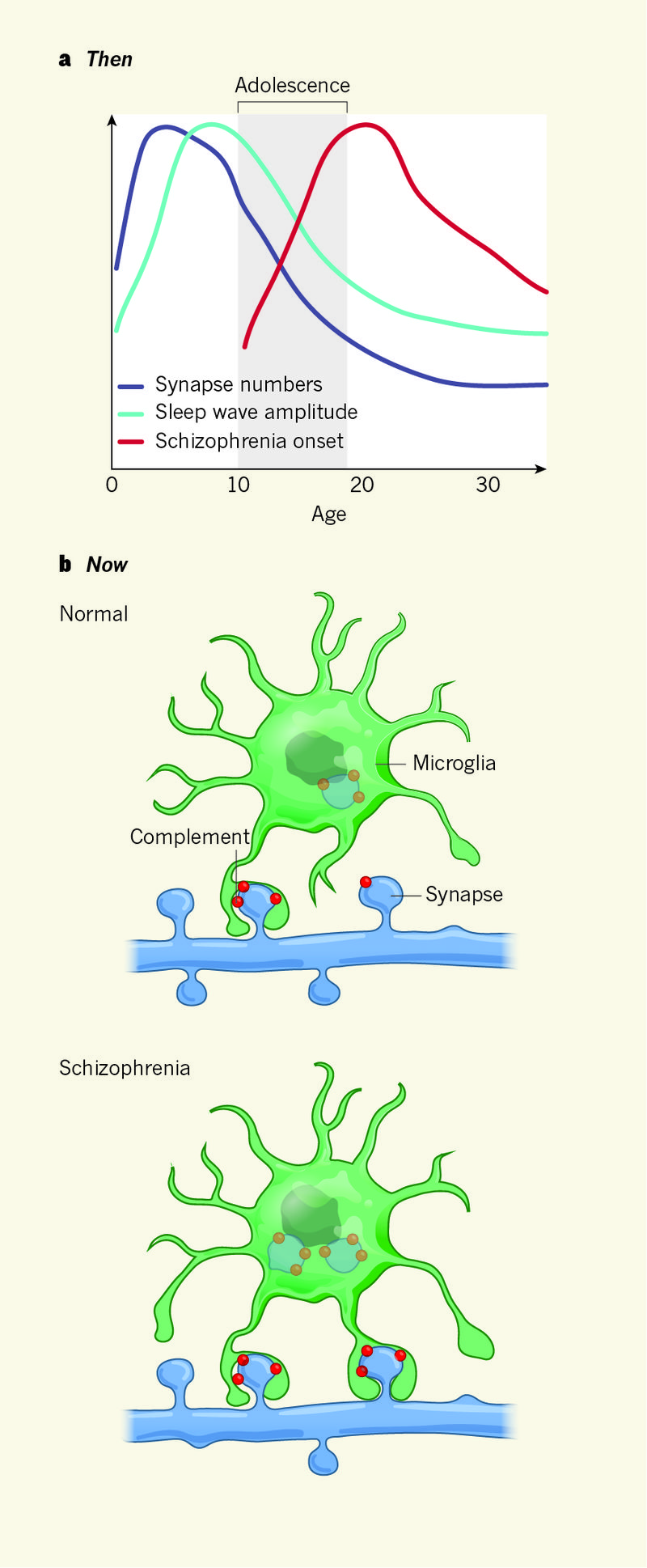
Илл. 2. Прогресс в понимании процессов перестройки мозга в подростковом возрасте. а) Исследование численности синапсов в разновозрастной когорте испытуемых, проведенное в 1979 году, выявило значительное снижение синаптической плотности в подростковом возрасте. Похожие возрастные изменения претерпевает и амплитуда электрических колебаний мозга. Более того, именно в подростковом возрасте обычно возникают первые симптомы шизофрении. На основании данных фактов психиатр Ирвин Файнберг, изучавший механизмы сна, предположил в 1983 году, что сбой процесса синаптического прунинга в подростковом возрасте провоцирует развитие шизофрении. б) Молекулярно-биологические и генетические исследования, проведенные в последние 10 лет, показали, что дефекты прунинга связаны с сигнальным каскадом системы комплемента. При нормальном развитии, иммунные клетки мозга (микроглия) захватывают и отсекают синапсы, помеченные белками системы комплемента. Повышенная экспрессия одного из генов данной системы (C4) ассоциирована с повышенным риском развития шизофрении – возможно, из-за более активного прунинга синапсов.
Ряд других генов, участвующих в работе синапсов и рассеянных по всему геному, также ассоциирован с шизофренией посредством многочисленных генных вариаций. Скорее всего, заболевание вызывается разными причинами у разных пациентов. Недавно появились новые методы, позволяющие распутать этот клубок взаимодействий. Существуют, к примеру, способы перепрограммирования стволовых клеток либо клеток кожи человека в нейрональные клетки, и методы выращивания трехмерных "мини-мозгов" в пробирках. Благодаря этому теперь существует возможность изучать развитие синапсов и процессы прунинга, используя клетки, взятые еще при жизни пациента либо клетки, геном которых был перепрограммирован таким образом, чтобы содержать вариации, ассоциированные с заболеванием. Более того, методы редактирования генома, такие как CRISPR-Cas, позволяют создавать модели развития синаптических соединений в лобной доле с использованием подопытных приматов, а также моделировать развитие психических заболеваний.
Вряд ли следует винить научное сообщество в том, что гипотеза Файнберга о прунинге была принята с прохладцей в момент её появления: в то время подобные гипотезы не выходили за рамки абстрактных размышлений, не подлежащих эмпирической проверке. Да и сам Файнберг писал: "Шансы на то, что нам с нашими ограниченными знаниями удастся угадать конкретные нейробиологические механизмы, вызывающие шизофрению, пренебрежимо малы". Но все же сегодня, хотя мы только подступаемся к пониманию молекулярных механизмов, связанных с его гипотезой, накопленные данные позволяют предположить, что Файнбергу хотя бы отчасти удалось именно это.
Источник: новостная заметка в журнале Nature - "Pruning hypothesis comes of age" (Matthew B. Johnson & Beth Stevens)
Перевод : Тимеев Артём Геннадьевич (переводы фармакологических, биотехнологических текстов с русского на английский и с английского на русский; email: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.)
- 1. Feinberg, I. J. Psychiatr. Res. 17, 319–334 (1982–1983).
- 2. Huttenlocher, P. R. Brain Res. 163, 195–205 (1979).
- 3. Feinberg, I., Koresko, R. L. & Heller, N. J. Psychiatr. Res. 5, 107–144 (1967).
- 4. Sham, P. C., MacLean, C. J. & Kendler, K. S. Acta Psychiatr. Scand. 89, 135–141 (1994).
- 5. Elston, G. N. & Fujita, I. Front. Neuroanat. 8, 78 (2014).
- 6. Huttenlocher, P. R. & Dabholkar, A. S. J. Comp. Neurol. 387, 167–178 (1997).
- 7. Petanjek, Z. et al. Proc. Natl Acad. Sci. USA 108, 13281–13286 (2011).
- 8. Garey, L. J. et al. J. Neurol. Neurosurg. Psychiatr. 65, 446–453 (1998).
- 9. Glantz, L. A. & Lewis, D. A. Arch. Gen. Psychiatry 57, 65–73 (2000).
- 10. Gogtay, N. et al. Proc. Natl Acad. Sci. USA 101, 8174–8179 (2004).
- 11. Cannon, T. D. et al. Biol. Psychiatry 77, 147–157 (2015).
- 12. The International Schizophrenia Consortium. Nature 460, 748–752 (2009).
- 13. Schizophrenia Working Group of the Psychiatric Genomics Consortium. Nature 511, 421–427 (2014).
- 14. Sekar, A. et al. Nature 530, 177–183 (2016).
- 15. Stevens, B. et al. Cell 131, 1164–1178 (2007).
- 16. Schafer, D. P. et al. Neuron 74, 691–705 (2012).