De novo мутации гена CIC, вызывающие потерю функции гена, способствуют развитию церебральной фолатной недостаточности через снижение экспрессии FOLR1
(Скачать перевод в формате PDF)
Сюанье Цао (Xuanye Cao),1 Annika Вольф (Annika Wolf),2 Сунь-Ен Ким (Sung-Eun Kim),3 Роберт М. Кабрера (Robert M. Cabrera),1 Богдан Влодарчик (Bogdan J. Wlodarczyk),1 Хуэйпин Чжу (Huiping Zhu),4 Маргарет Паркер (Margaret Parker),3 Ин Лин (Ying Lin),1 Джон Стил (John W. Steele),1,5 Сяо Хань (Xiao Han),1 Винсент Рамаэкерс (Vincent Th Ramaekers),6 Роберт Стейнфилд (Robert Steinfeld),2,7 Ричард Финнел (Richard H. Finnell),3,8,9 Юньпин Лэй (Yungping Lei)1
АННОТАЦИЯ
Актуальность. Синдром церебральной фолатной недостаточности (ЦФН) характеризуется низкой концентрацией 5-метилентетрагидрофолата в спинномозговой жидкости при сохранении концентраций фолата в плазме крови и в эритроцитах в нижней части нормального диапазона. У пациентов с ЦФН были описаны мутации в нескольких генах, связанных с фолатной цепочкой, в том числе в гене FOLR1 (фолатный рецептор альфа, FRα), DHFR (дигидрофолатредуктаза) и PCFT (протон-сопряженный транспортер фолатов).
Методы. Задавшись целью обнаружить мутации, приводящие к ЦФН, мы осуществили полноэкзомное секвенирование в восьми «семейных тройках» с ЦФН, и выявили восемь de novo мутаций в семи из них.
Результаты. Мы обнаружили примечательную de novo нонсенс-мутацию типа «stop gain» в гене CIC (капикуа). Исследовав валидационную когорту, составленную из 48 пациентов со спорадически возникшей ЦФН, мы выявили еще три редких вариации гена CIC, предположительно имеющих патологический характер. По данным функционального анализа, CIC связывается с октамерной последовательностью в промоторном участке следующих генов, связанных с транспортом фолатов: FOLR1, PCFT и гена переносчика восстановленных фолатов (Slc19A1; RFC1). Нонсенсный вариант гена CIC (p.R353X) снизил экспрессию FOLR1 как в клетках HeLa, так и в индуцированных плюрипотентных стволовых клетках (иПСК), взятых у исходного пробанда с ЦФН. Исследование связывания фолата показало, что вариант p.R353X снижает связывание фолиевой кислоты клетками.
Заключение. Результаты указывают на то, что генетические варианты, вызывающие потерю функции CIC, составляют часть генетической этиологии ЦФН, воздействуя на экспрессию FOLR1. В нашем исследовании впервые описаны способствующие развитию ЦФН мутации гена, не являющегося частью фолатной цепочки.
ВВЕДЕНИЕ
Под церебральной фолатной недостаточностью (ЦФН) понимают любой неврологический синдром, при котором в спинномозговой жидкости (СМЖ) пациента снижена концентрация 5-метилтетрагидрофолата (5-MTHF), при этом концентрация фолата в сыворотке крови обычно находится в нижней части нормального диапазона.1 Концентрация фолата в СМЖ у человека в норме превышает концентрацию фолата в сыворотке крови в 1.5 и более раз. Ввиду крайней необходимости фолата для нормального развития и для производства биогенных аминов и птеринов в центральной нервной системе, у пациентов с пренатальной и постнатальной фолатной недостаточностью наблюдаются разнообразные неврологические симптомы, в том числе умственная отсталость, эпилепсия, атаксия и пирамидные симптомы.2 Абсорбция фолата в кровь из желудочно-кишечного тракта происходит в основном с использованием двух систем: переносчика восстановленных фолатов 1 (RFC1; ген SCL19A1) и протон-сопряженного транспортера фолатов (PCFT).3 Захват фолата из крови начинается с его связывания с фолатным рецептором альфа (FRa/FOLR1) на базолатеральной поверхности эпителиальных клеток сосудистого сплетения. Захваченный фолат посредством рецепторно-опосредованного эндоцитоза и трансцитоза переносится через гематоэнцефалический барьер и попадает в спинномозговую жидкость (СМЖ).4 FOLR1 демонстрирует высокую экспрессию в сосудистом сплетении и обладает более высокой аффинностью к фолиевой кислоте (ФК) при нейтральном pH, чем другие транспортеры фолата, такие как PCFT и RFC1.5 Эти две характеристики являются важными факторами для достижения и поддержания в СМЖ более высокой концентрации фолата, чем в сыворотке крови. Ранее в исследованиях было продемонстрировано развитие ЦФН при нарушении функции FOLR1, как из-за мутаций гена FOLR1,6 7 так и из-за появления аутоантител к FOLR1.8 Также сообщалось о снижении концентрации MTHF в СМЖ у носителей мутаций в других генах, связанных с фолатом, таких как DHFR9,10 и PCFT.11,12 Мы сообщали о пациентке, у которой была выявлена de novo мутация с усечением гена CIC.13 При обращении за помощью у пациентки был диагностирован B-клеточный острый лимфобластный лейкоз (B-ОЛЛ). Пациентке был назначен метотрексат (МТ). У нее развился целый ряд неврологически-поведенческих отклонений, в том числе признаки расстройства аутистического спектра, судороги, потеря языковых и двигательных навыков, а также была выявлена ЦФН, которая не исчезла после ремиссии опухоли и отмены МТ.
Ген CIC был открыт в организме дрозофилы – у этого насекомого высокая экспрессия гена наблюдается в области головы и области хвоста,14 отсюда и название “capicua”, означающее на каталанском языке «голова и хвост». Продукт гена – репрессор транскрипции, принадлежащий к семейству белков, содержащих в своей структуре домен под названием «HMG-бокс». Белки семейства используют домен HMG-бокс и домен C1 для связи с октамерной ДНК-последовательностью T(G/C)AATG(A/G)A в геноме организма.15 Известно, что в клеточное ядро белок CIC переносится нуклеарным импортином KPNA3, причем за взаимодействие с CIC в структуре импортина отвечает C-терминальная последовательность под названием «сигнал ядерной локализации» (nuclear localization signal domain).16 Было установлено, что белок действует «вниз по течению» от сигнальной цепочки EGF-RTK-RAS-ERK-MAPK, контролируя формирование паттернов в период эмбриогенеза.14 Также недавно были получены свидетельства возможного воздействия CIC на сигнальную цепочку Toll/интерлейкин-1.17 В ряду наиболее известных генов, которые расположены ниже CIC в сигнальной цепочке – члены семейства «активатор 3 полиомавирусного энхансера», гены ETV1, ETV4 и ETV5, а также гены матриксной металлопротеиназы 9 (MMP9)18 и 24 (MMP24).19 При отсутствии сигнала в цепочке EGFR-ERK белок CIC связывается с вышеуказанными генами и подавляет их экспрессию, а при активации цепочки происходит деактивация CIC посредством либо деградации белка, вызванной фосфорилированием, либо релокализации белка из ядра в цитоплазму.20–23 В организме млекопитающих CIC формирует комплекс репрессии транскрипции совместно с атаксином-1, геном, ассоциированным с развитием спиноцеребеллярной атаксии 1-го типа.24 При классическом нокауте гена Cic у мышей наблюдается омфалоцеле, аномально низкая величина помета и дефекты дифференциации клеток легких, что приводит к гибели животных в перинатальном периоде.18,25 При условном нокауте гена CIC в раннем послеродовом периоде у мышей отмечается нарушение формирования переднего мозга, что приводит к гиперактивности, сниженной способности к обучению и нарушению памяти.13 У взрослых мышей системная условная деактивация гена CIC приводит к развитию острого T-клеточного лимфобластного лейкоза. Также сообщалось о том, что при недостаточности CIC изменяются показатели периферической иммунной толерантности вследствие аберрантной активации системы приобретенного иммунитета.26 Была продемонстрирована ассоциация мутаций гена CIC у людей с несколькими патологиями, в том числе с нейроповеденческими отклонениями,13 олигодендроглиомой,27 легочной карциномой19 и раком предстательной железы.28
В отличие от исследований человеческого гена CIC при ОЛЛ, продемонстрировавших сильную ассоциацию гена с этим заболеванием и с рядом аномальных нейроповеденческих фенотипов, возможный вклад мутаций гена CIC в этиологию ЦФН ранее не демонстрировался. Более того, ранее не проводилось комплексных генетических исследований семейных троек с ЦФН. Поскольку у описанного выше пациента с усечением гена CIC не было выявлено редких вариаций генов с доказанной ролью в развитии ЦФН (FOLR1, PCFT, RFC1), перечисленных в имеющемся у нас массиве данных полноэкзомного секвенирования (ПЭС), мы предположили, что усечение белка CIC может играть роль в развитии ЦФН. Следовательно, в развитии ЦФН могут участвовать генетические факторы, отличные от мутаций в уже известных генах, связанных с транспортом фолата. Для лучшего понимания этиологии ЦФН определенно необходимо тщательное генетическое профилирование пациентов с ЦФН с последующей проверкой возможной роли мутаций гена CIC в развитии заболевания. Мы осуществили ПЭС в восьми семейных тройках с ЦФН, а также у 48 пациентов со спорадически развившейся ЦФН. В семи различных семейных тройках было выявлено восемь de novo мутаций. В когорте из 48 спорадических пациентов с ЦФН мы выявили еще три редкие патологические мутации гена CIC. Наконец, мы осуществили функциональный анализ усеченного de novo варианта гена CIC, и продемонстрировали, что усечение CIC приводит к дисрегуляции генов, отвечающих за транспорт фолата, в клетках HeLa и в индуцированных плюрипотентных стволовых клетках (иПСК), созданных из клеток пациентов. В целом полученные нами результаты являются первыми данными, полученными при генетическом анализе семейных троек с ЦФН, и расширяют наше понимание нового аспекта этиологии ЦФН.
Материалы и методы
Субъекты исследования
Исходный пробанд в нашем исследовании был обнаружен в результате обращения матери пациента. Было также привлечено 48 дополнительных субъектов, из которых в отношении некоторых (10) у нас была возможность собрать образцы биоматериала у родителей субъекта, а в отношении остальных (38) такой возможности не было. Концентрация фолата в СМЖ измерялась в больницах, в которых происходило лечение субъектов. Описания ДНК-образцов 48 субъектов, полученных от различных генетических и нейропедиатрических лечебных учреждений Германии, Финляндии, Швейцарии, Нидерландов, Великобритании и США были представлены в опубликованной нами ранее работе.7 Проведение исследования было одобрено экспертным советом при Техасском университете в Остине. На получение каждого образца было дано письменное информированное согласие родителями субъектов.
Секвенирующий анализ образцов ДНК
Библиотеки для ДНК-секвенирования были построены с помощью набора NEBNext Ultra DNA Library Prep Kit (New England Biolabs) с использованием протоколов, предоставленных производителем набора (V.3.0). Для обогащения экзома использовали набор Agilent SureSelect Human All Exon V5 (Agilent Technologies). Секвенирование библиотек было осуществлено Отделом геномного секвенирования и анализа при Техасском университете в Остине с помощью платформы Illumina Hi-Seq 2000 (Illumina). Анализ данных, полученных методами секвенирования нового поколения, производился в согласии с рекомендациями GATK Best Practices (https://software.broadinstitute.org/gatk/best-practices/). Данные в формате FASTQ были оперативно картированы на геном hg19 с помощью программного обеспечения для BWA-выравнивания,29 а затем отсортированы и проиндексированы с помощью SAMtools.30 После этого была проведена рекалибровка качества оснований с помощью GATK31 и удаление дубликатных прочтений с помощью программного обеспечения Picard (https://broadinstitute.github.io/picard/). Определение вариантов осуществляли с помощью методов программного обеспечения GATK HaplotypeCaller. Анализ de novo вариантов производился с помощью программы TrioDeNovo.32 Для аннотации вариантов использовали программу Annovar.33 Секвенирование по Сенгеру производили с использованием ранее опубликованных праймеров и протоколов.34 Праймеры для секвенирования гена CIC приведены в сопроводительной таблице 1, опубликованной онлайн. Для предсказания функции вариантов использовались инструменты Polyphen2, SIFT и CADD.35–37 Аллельную частоту каждой мутации оценивали с помощью базы данных gnomAD.38
Приготовление плазмид и информация о миРНК
Плазмиды GFP-CIC и HA-KPNA3 были предоставлены доктором Кэрол Макинтош (Carol MacKintosh) из Университета Данди. Вариант гена CIC был интегрирован в плазмиду GFP-CIC с помощью системы GeneArt Site-Directed Mutagenesis System (Кат. №A14604, Thermofisher Scientific). Плазмиды с атаксином-1 были предоставлены доктором Худой Зогби из Бэйлорского медицинского колледжа (Addgene Кат. № 48189).
Полноразмерный человеческий ген CIC и вариант гена CIC были интегрированы с помощью EcoRI/SalI в экспрессионный вектор pLVX-IRES-puro (Takara Bio), содержащий открытую рамку считывания EGFP. Векторы pMD2.G и psPAX2 для производства лентивирусных частиц были получены от Addgene (плазмиды №12259, №12260, помещены в каталог Дидье Троно). Плазмида pGL3-basic была получена из коммерчески доступного источника (Promega). Была осуществлена ПЦР-амплификация промоторной области гена FOLR1, после чего она была интегрирована в плазмиду pGL3-basic с помощью субклонирования. Набор ON-TARGETplus SMARTpool, приспособленный для работы с геном CIC и состоящий из четырех индивидуальных миРНК (GCUUAGUGUAUUCGGACAA, CGGCGCAAGAGACCCGAAA, GAGAAGCCGCAAUGAGCGA и CGAGUGAUGAGGAGCGCAU) был приобретен у компании Dharmacon - этот набор ранее уже упоминался.16 Универсальная миРНК с произвольной последовательностью, представляющая собой образец отрицательного контроля, была приобретена у компании Sigma-Aldrich (каталожный номер SIC005).
Создание стабильных клеточных линий и анализ внутриклеточной локализации
Для производства вируса клетки HEK293K подвергали котрансфекции плазмидами pMD2.G, psPAX2 и pLVX-GFP-puro, содержащими ген CIC «дикого типа» (WT, wild type) либо CIC с мутацией p.R353X, с помощью кальций-фосфатного метода. Через 48 часов содержащую вирусы надосадочную жидкость собирали, пропускали через фильтр с размером пор 0.45 мкм, и осаждали с помощью полиэтиленгликоля 6000. Инфицирование лентивирусом производилось в присутствии полибрена 5 мкг/мл. Отбор инфицированных клеток HeLa и Caco-2 производился с помощью пуромицина (1 мкг/мл). Клетки HeLa и Caco-2, стабильно экспрессирующие GFP-CIC wildtype, GFP-CIC p.R353X либо GFP (контрольный образец), фиксировали параформальдегидом на покровных стеклах. Внутриклеточную локализацию оценивали с помощью лазерного сканирующего конфокального микроскопа (LSM710; Leica, Вецлар, Германия), рассматривая клетки с GFP и с эндогенным CIC. Ядра окрашивали 4',6-диамидино-2-фенилиндолом (ДАФИ, 300 нг/мл).
Коиммунопреципитация и иммуноблот-анализ
Воздействие мутации p.R353X на взаимодействие CIC с KPNA3 и ATXN1 анализировалось в согласии с ранее опубликованными протоколами.16,24 Осуществляли кратковременную котрансфекцию клеток HEK293T wildtype-плазмидами либо плазмидами с мутацией p.R353X, а также плазмидами KPNA3 либо ATXN1. Через 24 часа после трансфекции производился харвест клеток с помощью лизирующего буферного раствора RIPA. GFP-антитело для коиммунопреципитации и иммуноблоттинга было приобретено у компании ThermoFisher (номер в каталоге A-11120). Антитело к KPNA3 было приобретено у компании Bethyl Laboratories (Монтгомери, Техас, США).
Оценка регулировки экспрессии генов FOLR1, PCFT, RFC1 в клетках с мутацией CIC p.R353X производилась с помощью иммуноблоттинга с использованием антитела к FOLR1 (Mov18), антитела к PCFT (Abcam), антитела к RFC1 (Santa Cruz Biotechnology), и антитела к β-актину (Кат.№ 8-7A5, Developmental Studies Hybridoma Bank при Университете штата Айова).
Анализ связывания фолиевой кислоты (ФК) и измерение концентрации ФК
Анализ связывания ФК осуществляли в соответствии с ранее опубликованными описаниями методик.7 Клетки со стабильной экспрессией GFP, GFP-CIC WT или GFP-CIC R353X подвергали кратковременному воздействию фолиевой кислоты: 15 минут, 5 нмоль/л [3H] ФК (Moravek Biochemicals) в присутствии либо без использования не-меченной ФК с концентрацией 500 нмоль/л. После трех отмывок с использованием охлажденного до температуры льда сбалансированного солевого раствора Хэнкса связанную с клеточной поверхностью меченую ФК высвобождали с помощью кислотного буфера, затем измеряли концентрацию с помощью жидкостного сцинтилляционного спектрометра. Уровень ФК-специфичного связывания вычисляли как разницу между уровнями [3H] ФК, связавшейся в присутствии и в отсутствие раствора немеченой ФК с концентрацией 500 нмоль/л. Стабильно трансфицированные клетки HeLa из добавочной лунки лизировали в 0.2М растворе NaOH, затем определяли количество белка с помощью набора BCA («метод с бицинхониновой кислотой», Pierce). В качестве контроля использовали GFP. Концентрацию ФК в стволовых клетках H9 и в индуцированных плюрипотентных стволовых (иПСК) клетках человека измеряли с помощью набора FA ELISA (BioVision).
Анализ иммунопреципитации хроматина
Иммунопреципитацию хроматина (ИХ) осуществляли в соответствии с протоколом, опубликованным Nelson et al.39 Клетки были подвергнуты кратковременному воздействию формальдегида с целью кросслинкинга, затем подвергнуты лизису с помощью IP-буфера (150 мМ NaCl, 50 мМ Трис-HCL (PH7.5), 5 мМ ЭДТА, NP-40 (0.5% об/об), Triton X-100 (1.0% об/об)). Клеточный лизат, содержащий осажденные ядра клеток, получали путем изоляции и разрушения образца с помощью ультразвукового диспергатора Misonix Sonicator 4000 (Qsonica LLC, Ньютаут, Коннектикут) в холодной воде с использованием зонда размером 5.5 дюймов типа «cup horn». Проводили 15 20-секундных сессий («пульсов») с амплитудой 60 и 30-секундными перерывами между пульсами. Образцы хроматина разделяли на 2 части, одну из которых инкубировали с антителом к CIC (предоставленным доктором Худой Зогби), другую инкубировали с антителом IgG (Santa Cruz Biotechnology), выступавшей в роли негативного контроля. Для преципитации комплекса «хроматин-белок-антитело» использовали микрогранулы, покрытые белком A. Иммуннопреципитированный хроматин и общую ДНК очищали с помощью Chelex-100 (Bio-Rad, кат. № 142-1253) в согласии с протоколом, опубликованным Nelson et al.33 Очищенную ДНК подвергали количественной ПЦР в реальном времени (qRT-PCR) с помощью праймеров, специфичных к промоторам эндогенных генов FOLR1, PCFT, RFC1. Аминокислотные последовательности праймеров для qRT-PCR представлены в дополнительной таблице, опубликованной онлайн.
Люциферазная реакция
Промоторная область гена FOLR1, содержащая CIC-связывающий(е) мотив(ы), была подвергнута ПЦР-амплификации и субклонирована в вектор pGL3-Basic. Клетки HeLa выращивали в «Модифицированной по способу Дульбекко среде Игла» (Dulbecco's Modified Eagle Medium, DMEM) с добавлением 10% фетальной бычьей сыворотки (ФБС) и 1% раствора пенициллина+стрептомицина (П/С). Клетки засеивали в 24-луночные планшеты за 1 день до трансфекции. По достижении 24 часов в культуре клетки (с конфлюэнтностью 70%-80%) трансфицировали, внося 1 мкг плазмид GFP-CIC и плазмид pGL3, и 20 нг плазмиды pRL-TK в качестве внутреннего контроля с липофектамином 2000 (ThermoFisher Scientific). Еще через 24 часа культивирования трансфицированные клетки были подвергнуты лизису с помощью 0.5 мл лизисного буфера (Promega), инкубированы на льду 10 минут, затем центрифугированы при 5000 об/мин на протяжении 5 минут. После этого анализировали активность люциферазы в надосадочной жидкости (50 мкл) посредством анализа репортерного гена двойной люциферазы (Dual-luciferase Reporter Assay) с помощью микропланшетного ридера Synergy HT Multi-Mode Microplate Reader (BioTek Instruments, Уинуски, штат Вермонт, США). В ходе каждого анализа производилось три независимых эксперимента по трансфекции в трех повторностях.
Культивирование фибробластов пациента и индуцированные плюрипотентные стволовые клетки (иПСК)
Образец кожи брался в согласии с правилами, одобренными Экспертным советом при Техасском университете в Остине и Сетонской сетью больниц. Фибробласты, полученные при биопсии кожи, культивировали в среде Дульбекко в модификации Искова (IMDM, Iscove’s Modified Dulbecco’s Medium) с добавлением 10% ФБС и 1% раствора П/С, при нормальных условиях культивирования клеток (37°С и 5% CO2), затем помещали на хранение в жидкий азот. Аликвоту, содержащую 105 фибробластов, подвергали перепрограммированию при третьем пересеве посредством внесения четырех факторов Яманаки (Oct4, Sox2, Kif4, c-Myc)40 с использованием набора CytoTune-iPS 2.0 Sendai Reprogramming Kit (ThermoFisher Scientific) и придерживаясь протокола, предоставленного производителем. Среду меняли каждые 24 часа на протяжении 6 дней после трансдукции. На 7-й день клетки собирали с помощью 0.05% раствора трипсин/ЭДТА и переносили в чашки с y-иррадиированными эмбриональными мышиными фибробластами в среде для человеческих эмбриональных стволовых клеток (KO DMEM с добавлением 20% KO-сыворотки, 20 мМ глутамакса, 1% раствора П/С, 0.1 мМ β-меркаптоэтанола, 1% неэссенциальных аминокислот и 10 нг/мл бФРФ (базовый фактор роста фибробластов, ThermoFisher Scientific)). Примерно через 14 дней происходило формирование колоний иПСК. Вручную собирали четыре колонии, которые затем пассировали для экспансии, кариотипирования и замораживания. После третьего пассажа колонии иПСК переносили в планшеты, покрытые слоем смеси Matrigel и содержащие среду mTeSR1 (Stemcell) для поддержания колоний без подкармливающих клеток. Кариотипирование осуществлялось в Исследовательском институте WiCell в Мэдисоне (Висконсин, США). Отсутствие вирусного вектора Сендай в иПСК проверяли с помощью набора Applied Biosystems TaqMan iPSC Sendai Detection Kit (Applied Biosystems A13640).
Детекция аутоантител к FOLR1
Выявление наличия и определение относительного количества аутоантител к FOLR1 в образцах сыворотки осуществляли в соответствии с ранее опубликованной процедурой.41–43 Для детекции IgG и IgM использовали меченные пероксидазой хрена (HRP) антитела к IgG (каталожный № I8640 Sigma Aldrich) и IgM (каталожный № I8260, Sigma Aldrich). В качестве негативного контроля использовали сыворотку со сниженным содержанием антител (antibody-depleted sera, Sigma Aldrich). Воздействие сыворотки в плане блокировки связывания фолиевой кислоты с фолат-связывающим белком определялось с помощью HRP-меченой фолиевой кислоты (FA-HRP, Ortho-Clinical Diagnostics, Raritan, New Jersey, USA). Удаление фолиевой кислоты из образцов сыворотки осуществлялось в соответствии с описанной ранее процедурой.44 Для построения калибровочной кривой немеченую фолиевую кислоту добавляли (0.01–2000 нг/мл) в очищенную от фолиевой кислоты сыворотку с пониженным содержанием антител. В качестве субстрата для детекции активности пероксидазы хрена использовали SuperSignal ELISA Femto Substrate (каталожный №37074, ThermoFisher Scientific). Изображения получали с помощью 96-луночного устройства визуализации (Q-View Imager, Quansys Biosciences). Интенсивность на изображениях оценивалась с помощью программного обеспечения Q-View Software. Концентрацию IgG, IgM и относительный уровень блокировки связывания ФК вычисляли с помощью калибровочных кривых.
Статистический анализ
Для построения графиков использовании программу Excel (Microsoft Excel, V.16.27). Статистический анализ осуществляли в программе R (R Core Team, 2013). Данные представляли в форме «среднее ± стандартная ошибка среднего». Все данные анализировали с применением двухвыборочного t-критерия Стьюдента.
РЕЗУЛЬТАТЫ
De novo-варианты, выявленные у пациентов с ЦФН
Образцы ДНК, взятые в восьми семейных тройках, затронутых ЦФН, подвергли полноэкзомному секвенированию. В семи тройках было обнаружено восемь de novo-вариантов (DNV) (таблица 1). Было установлено, что шесть из этих DNV представляют собой миссенсные мутации, а остальные два варианта являются мутациями типа «start loss» и «stop gain». Использование программы Polyphen либо программы SIFT показало, что четыре из шести миссенс-вариантов могут приводить к повреждениям.35 36 Мы осуществили оценку функции генов, содержащих предположительно вредные мутации, и обнаружили, что три гена (ATP1A1, SLC35A2, ABCA12) из шести связаны с системой активного транспорта. В отношении двух из этих генов ранее была установлена связь с развитием заболеваний, поражающих нервную систему. Мутации гена ATP1A1, кодирующего «альфа-1»-изоформу Na(+),K(+)-АТФазы, ранее были связаны с развитием аутосомно-доминантной разновидности болезни Шарко-Мари-Тута, поражающей аксоны (тип 2DD) (CMT2DD; OMIM: 618036),45 а также гипомагниемии с судорогами и тяжелой умственной отсталостью (HOMGSMR2; OMIM: 618314).46 Известно, что SLC35A2 отвечает за перенос уридин-5'-дифосфат-галактозы из цитоплазмы в аппарат Гольджи.47 Мутации гена SLC35A2 ассоциированы с развитием ранней младенческой эпилептической энцефалопатии-22 (EIEE22; OMIM: 300896).48 Полученные результаты указывают на то, что разные мутации генов, известных своей ролью в процессах активного транспорта, могут оказывать разное клиническое воздействие на пациентов.
Одна из двух вариаций, предположительно связанных с утратой функции гена (Loss-of-function, LoF), расположена в гене RGPD2 (NM_001078170:c.T2C:p.M1T), кодирующем белок-нуклеопорин, ранее не заподозренный в связи с каким-либо известным заболеванием. Вместе с тем ранее была установлена ассоциация других белков-нуклеопоринов с множеством заболеваний человека, в том числе с синдромом Дауна и B-ОЛЛ.49 Было бы интересно расследовать, дает ли данная мутация типа «start loss» вклад в этиологию ЦФН. Вторая LoF-мутация затрагивает ген CIC (NM_015125:c.C1057T p.R353X) (рисунок 1). У пациентки с этой мутацией ранее были диагностированы признаки расстройства аутистического спектра, судороги, утеря способностей к повторению фраз, сказанных другими людьми, и утеря двигательных навыков.13 Позже у нее были диагностированы симптомы, которые могут наблюдаться при церебральной фолатной недостаточности. Осуществив ПЭС, мы не выявили у пациентки редких вариантов известных генов, связанных с транспортом фолатов (FOLR1, PCFT и DHFR) (с аллельной частотой <0.1% в базе данных gnomAD). Мы также произвели секвенирование ДНК ее сиблингов и не обнаружили у них мутации, выявленной у пациентки. Решив проверить мутации гена CIC, который предположительно может способствовать развитию ЦФН, мы осуществили полноэкзомное секвенирование геномов 48 «спорадических» пациентов. Мы не обнаружили редких миссенс-вариантов, которые ранее были описаны в генах, традиционно связываемых с развитием ЦФН. Более того – у трех пациентов из данной когорты мы обнаружили редкие и предположительно патологические мутации (балл CADD > 20) в гене CIC (таблица 2). Мы связались с этими тремя семьями, смогли получить образцы ДНК членов семьи одного из трех пациентов (мутация CIC c.1008_1009InsTG), и осуществили секвенирование гена CIC методом Сенгера. Этот вариант гена CIC с измененной рамкой считывания (CIC c.1008_1009InsTG), обнаруженный у пациентки с ЦФН, не был выявлен у родителей и здоровых сиблингов пациентки (рисунок 1), что указывает на то, что эта мутация сдвига рамки считывания является de novo-мутацией. В сравнении с прогнозируемой частотой возникновения de novo-мутаций с потерей функции гена, у пациентов с ЦФН наблюдается значительно (p=7.05×10–5) повышенная частота de novo-вариаций гена CIC, предположительно приводящих к потере функции гена. В целом полученные данные указывают на повышенную частоту мутаций гена CIC у пациентов с ЦФН.
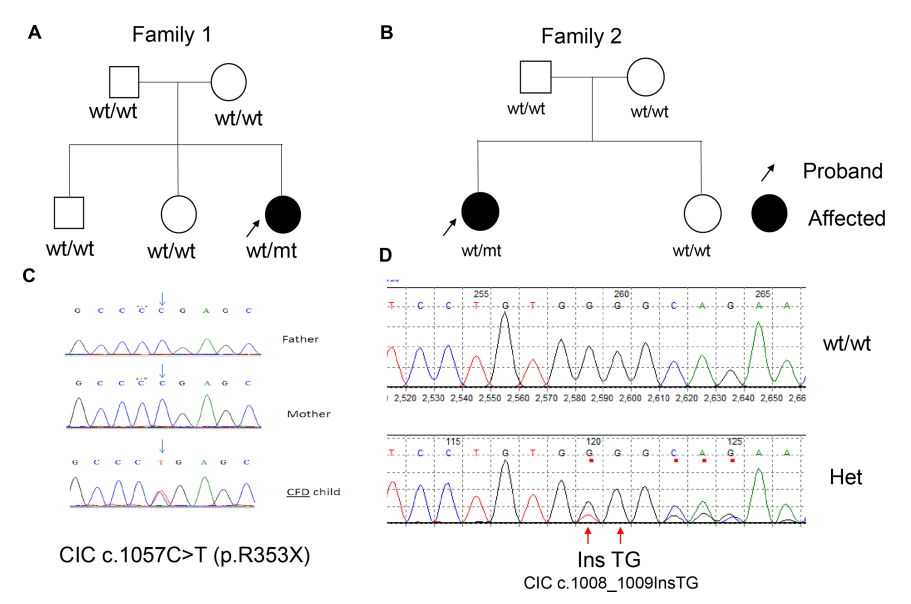
Рисунок 1. Выявление de novo-вариантов гена CIC в двух группах сибсов, затронутых ЦФН. (A) Генеалогия семьи №1. (B) Генеалогия семьи №2. (C) Хроматограмма результатов секвенирования пробанда (семья №1) и ее родителей. (D) Хроматограмма результатов секвенирования пробанда (семья №2) и здоровых сиблингов. ЦФН, церебральная фолатная недостаточность.
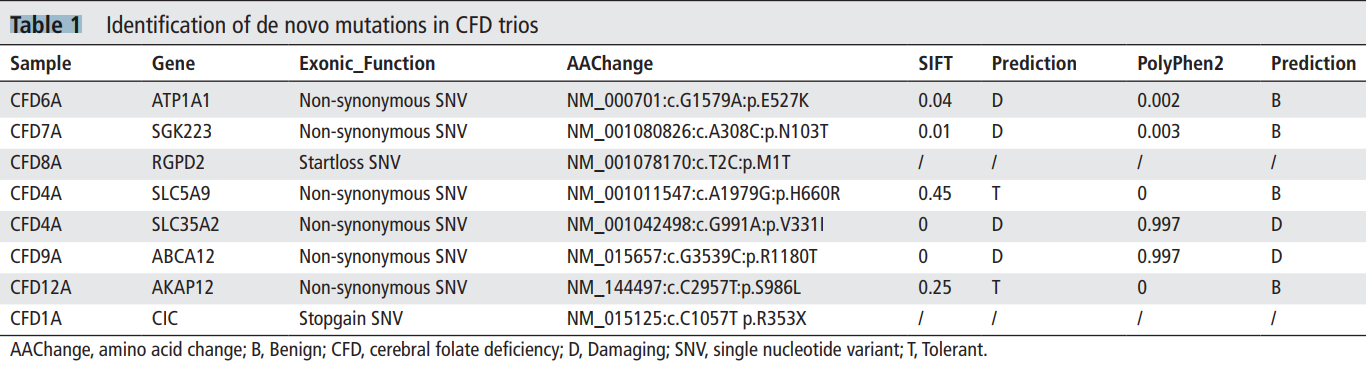
Таблица 1. Выявление de novo мутаций в семейных тройках с ЦФН
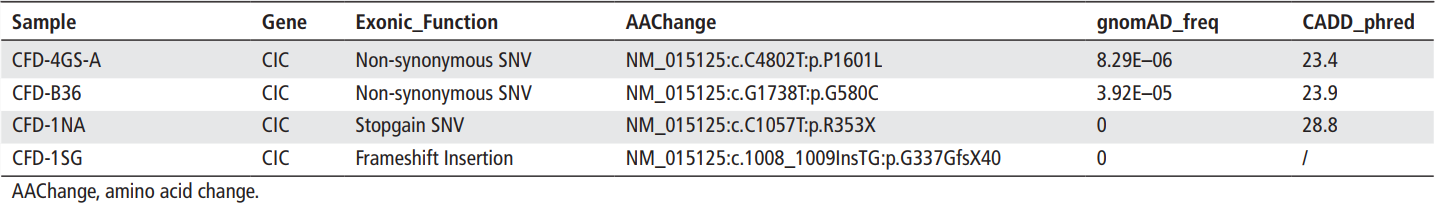
Таблица 2. Сводка всех редких мутаций гена CIC, выявленных в gnomAD_freq: информация из базы данных «аллельная частотность» коллекции gnomAD (балл CADD_pred рассчитан с помощью https://cadd.gs.washington.edu/score).
Внутриклеточная локализация и белок-белковые взаимодействия
С целью понять механизм, посредством которого мутации гена CIC могут способствовать развитию ЦФН, был осуществлен функциональный анализ с использованием усеченного варианта p.R353X гена CIC. Согласно прогнозу, сделанному по результатам анализа белковых доменов, мутация p.R353X гена CIC должна приводить к образованию стоп-кодона перед доменами C2, NLS1 и C1 (рисунок 2A), что должно сказываться на локализации белка CIC относительно ядра. Анализ внутриклеточной локализации показал, что белки CIC дикого типа со встроенной EGFP-последовательностью («EGFP-CIC») располагались в ядрах клеток, в то время как белки EGFP-CIC, содержащие мутацию p.R353X, обнаруживались по всему пространству клеток, в том числе в ядре, цитоплазме и клеточной мембране, повторяя картину распространения белка EGFP (рисунок 2B, дополнительный онлайн-рисунок 1). Воздействие варианта на взаимодействия CIC с KPNA3 либо ATXN1 оценивали методом коиммунопреципитации (Co-IP). В ходе Co-IP анализа наблюдали отсутствие взаимодействия CIC-KPNA3 при использовании варианта p.R353X (рисунок 2C); вместе с тем взаимодействие между мутантным CIC (p.R353X) и атаксином-1 удавалось обнаружить, пусть оно было и слабее, чем взаимодействие CIC дикого типа с атаксином-1 (рисунок 2D).
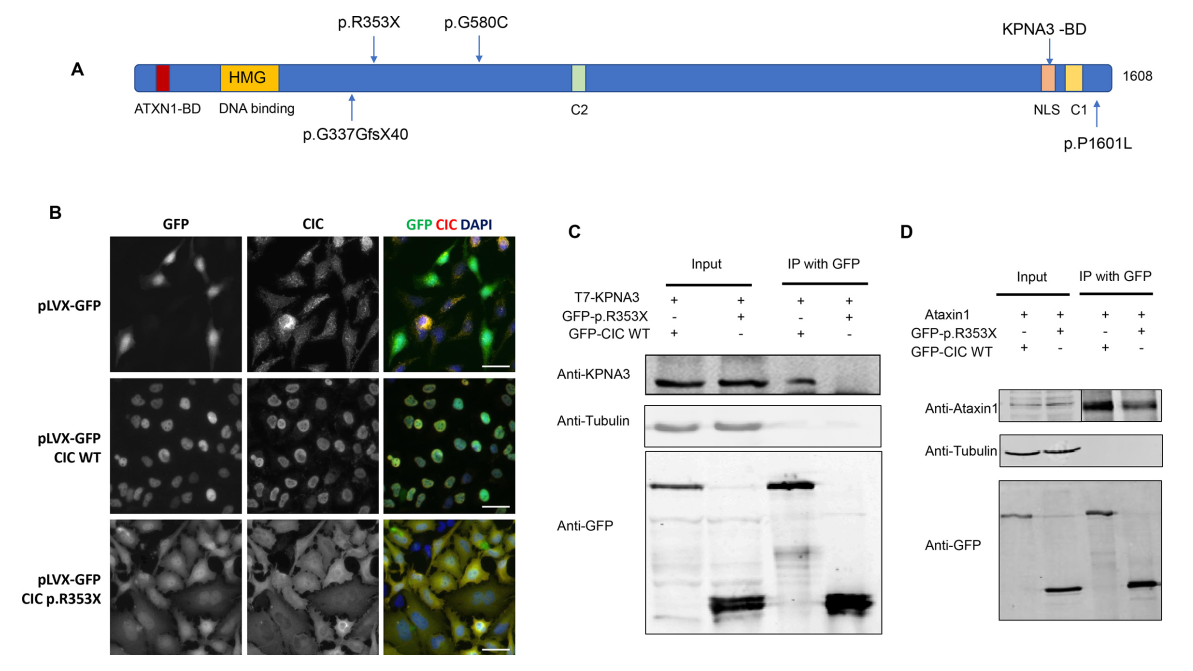
Рисунок 2. Функциональный анализ варианта CIC. (A) Белковый аминокислотный локус варианта p.R353X, который должен приводить к образованию преждевременных стоп-кодонов. На графике отображены все четыре мутации CIC, выявленные в нашей когорте пациентов с ЦФН.56 (B) Локализация GFP-меченных вариантов CIC в стабильно трансфицированных клетках HeLa. Клетки HeLa подвергали трансдукции с помощью лентивирусных частиц, кодирующих GFP, wildtype GFP-CIC либо GFP-CIC p.R353X. Внутриклеточную локализацию оценивали под микроскопом, выявляя GFP и эндогенный CIC. Ядра окрашивали 4',6-диамидино-2-фенилиндолом (ДАФИ). Масштабные линии: 20 мкм. (C) Анализ влияния варианта p.R353X гена CIC на взаимодействие CIC и KPNA3. Использование мутантного CIC приводило к потере взаимодействия CIC с KPNA3. (D) Анализ влияния варианта p.R353X гена CIC на взаимодействие CIC и ATXN1. ЦФН, церебральная фолатная недостаточность.
CIC связывается с промоторной областью FOLR1 и регулирует экспрессию FOLR1
Анализ октамерной последовательности в промоторной области гена FOLR1, связывающей ДНК гена CIC, в том числе двух тысяч пар оснований, лежащих выше по течению от сайта инициации транскрипции (+1), показал, что у гена имеется два сайта, связывающих CIC. Один из октамеров (TGAATGAA) располагался в позиции −1442 bp, а другой (TGAATGAA) в позиции −1419 bp (рисунок 3A). Октамеры, связывающие CIC, также были обнаружены в промоторной области гена PCFT и гена RFC1 в позициях −1243~−1236 bp и −1926~−1919 bp соответственно. Иммунопреципитация хроматина показала, что CIC физически связывается с промоторной областью генов FOLR1, PCFT и RFC1. По сравнению с контрольным антителом IgG, иммунопреципитация антителом к гену CIC осадила в 4.1 раза больше промоторной ДНК гена FOLR1, в 13.8 раз больше промоторной ДНК гена PFCT и в 4.2 раза больше промоторной ДНК гена RFC1 (рисунок 3B). В попытке выяснить, регулирует ли CIC активность промотора FOLR1, мы осуществили котрансфекцию клеток HeLa двумя разными конструкциями промотора FOLR1 (FR1 P4 либо FR1 P1+P4) и GFP-CIC дикого типа (wildtype), мутантным GFP-CIC либо GFP-pLVX. Обе FOLR1-промоторные конструкции содержали предположительные сайты связывания с CIC. Было отмечено значительное повышение активности люциферазы при использовании обеих FOLR1-промоторных конструкций, котрансфицированных с CIC wildtype (в 2.6 раза), в то время как при использовании варианта p.R353X гена CIC этот эффект был гораздо слабее (1.5–1.8 раза; рисунок 3C) – это указывает на то, что CIC регулирует экспрессию FOLR1. Повышение экспрессии CIC посредством трансфицирования 500 нг GFP-CIC wildtype-плазмиды в клетки HEK293T повышало экспрессию генов FOLR1, PCFT и RFC1 в 2.8 раза, 1.5 раза и 1.2 раза соответственно (рисунок 3D). Снижение экспрессии CIC на 43% посредством трансфекции миРНК снижало экспрессию FOLR1 и RFC1 значительно – на 20% (рисунок 3E).
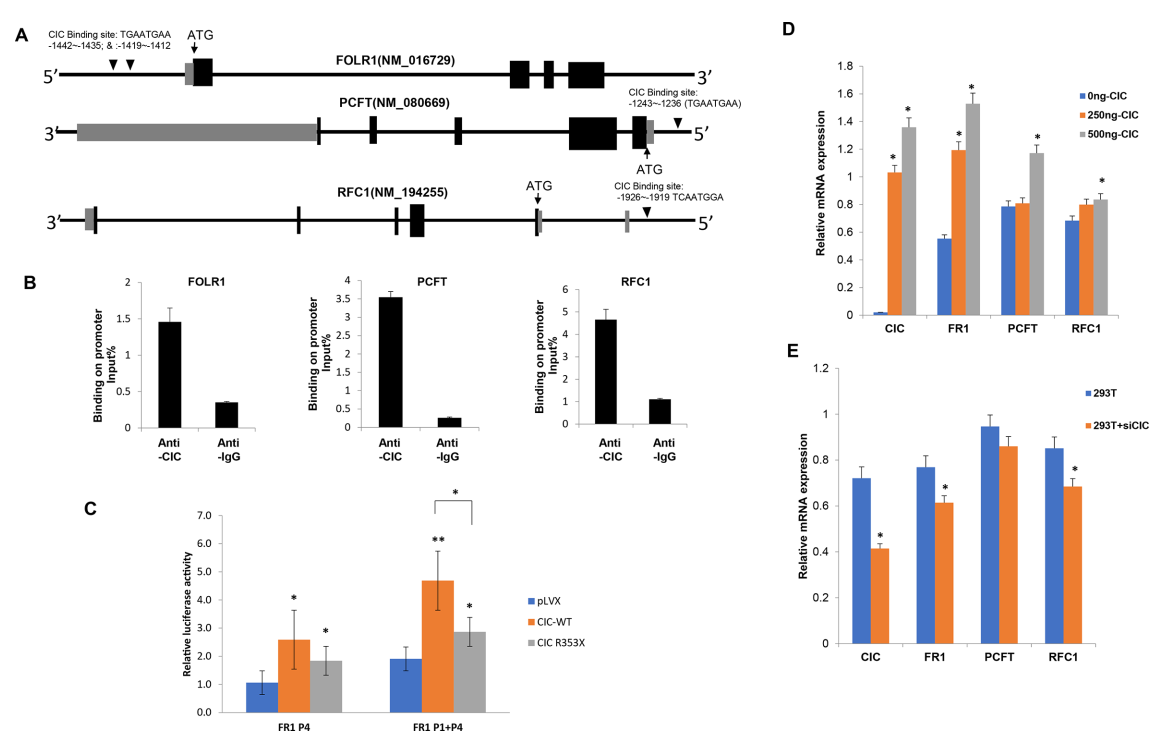
Рисунок 3. Регулировка экспрессии генов FOLR1, PCFT и RFC1 геном CIC дикого типа. (A) Распределение мотивов связывания ДНК гена CIC в структуре генов FOLR1, PCFT и RFC1. В промоторной области гена FOLR1 содержится два мотива связывания гена CIC, а гены PFCT и RFC1 содержат по одному мотиву связывания CIC. (B) Повышение экспрессии CIC посредством трансфицирования плазмидой GFP-CIC и уровни экспрессии генов FOLR1, PCFT и RFC1 по результатам реакции qRT-PCR. Избыточная экспрессия CIC значительно повышала экспрессию генов FOLR1 и PCFT. (C) Люциферазный анализ промотора FOLR1 показал, что CIC дикого типа способен стимулировать экспрессию комплекса «промотор FOLR1-люцифераза», в то время как способность мутантного гена CIC стимулировать экспрессию этого комплекса была снижена. Вычисляли t-критерий Стьюдента (*p<0.05; **p<0.005). (D) Нокдаун гена CIC с помощью анти-CIC миРНК (ми-CIC) и регулировка экспрессии трех генов фолатного транспорта – FOLR1, PCFT и RFC1. Вычисляли t-критерий Стьюдента (*p<0.05). (E) Нокдаун CIC значительно снижал экспрессию FOLR1. Вычисляли t-критерий Стьюдента (*p<0.05).
Вариант гена CIC снизил экспрессию гена FOLR1 в клеточных линиях
Для определения того, способен ли вариант p.R353X снижать экспрессию генов, связанных с транспортом фолатов, мы создали стабильные линии клеток HeLa и Caco-2, экспрессирующих GFP, GFP-CIC wildtype и GFP-CIC p.R353X.
В клетках HeLa как вестерн-блот, так и qRT-PCR анализ продемонстрировал при использовании GFP-CIC wildtype повышение экспрессии FOLR1 в 2.2 раза (p<0.01) по сравнению с контрольными клетками, экспрессировавшими GFP, в то время как в клетках с мутантным GFP-CIC наблюдалось снижение экспрессии FOLR1 на 51% (p<0.05) по сравнению с контрольными клетками, экспрессировавшими GFP. В трансфицированных клетках не было отмечено значительного изменения (p>0.05) экспрессии PCFT и RFC1 (рисунок 4A-C). Эффект снижения экспрессии FOLR1 при использовании мутантного варианта CIC по сравнению с CIC дикого типа был подтвержден в опыте с клетками Caco-2 (рисунок 4D-F).
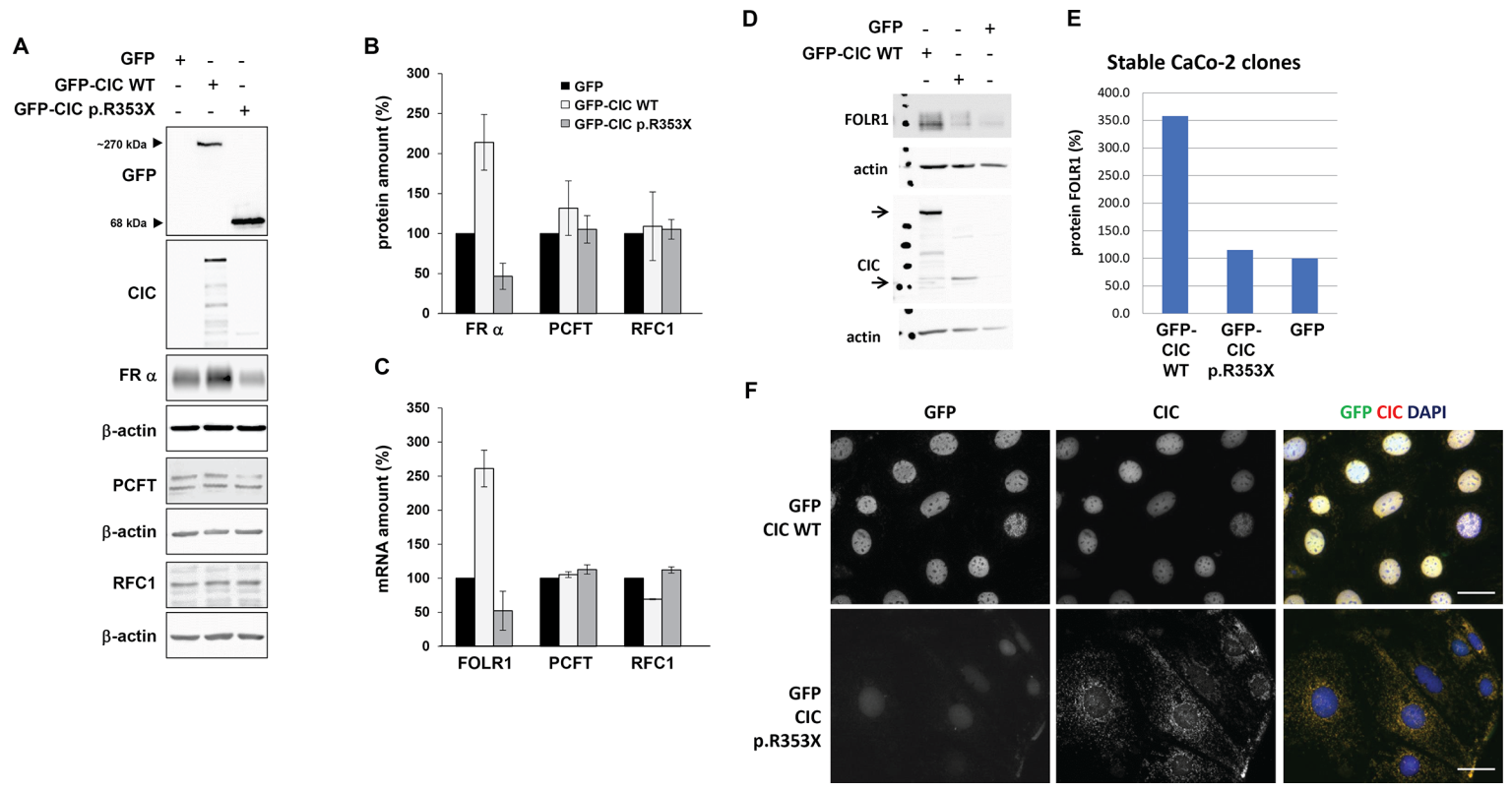
Рисунок 4. Ген CIC дикого типа и мутировавший ген CIC оказали регулирующее воздействие на транскрипцию гена FOLR1 в стабильно трансфицированных клетках HeLa. (A) Клетки HeLa подвергали трансдукции с помощью лентивирусных частиц, кодирующих GFP, wildtype GFP-CIC либо GFP-CIC p.R353X. Типичные снимки вестерн-блота эндогенного FOLR1 (FRα), PCFT и RFC1 и избыточно экспрессированного GFP-CIC. β-актин использовали для контроля нанесения образцов. (B) Оценка количества белка FOLR1, PFCT и RFC1 в сравнении с количеством в клетках HeLa, трансфицированных GFP (с нормализацией по β-актину, n=3). (С) Оценка уровней мРНК FOLR1, PCFT, RFC1 в клетках HeLa, стабильно трансфицированных GFP, GFP-CIC WT либо GFP-CIC p.R353X. Экспрессию нормализовали по уровню GAPDH (n=3). (D) Клетки Caco-2 подвергали трансдукции с помощью лентивирусных частиц, кодирующих GFP, wildtype GFP-CIC либо GFP-CIC p.R353X. Типичные снимки вестерн-блотов, отражающих экспрессию CIC и эндогенного FOLR1. Для контроля нанесения образцов использовали β-актин. (E) Оценка количества белка FOLR1 в сравнении с количеством в GFP-трансфицированных клетках Caco-2. (F) Локализация белка GFP-CIC дикого типа и GFP-CIC мутантного типа в клетках Caco-2. Масштабные линии 10 мкм.
Вариант гена CIC снизил экспрессию гена FOLR1 в иПСК пациента
Для выяснения того, снижает ли мутантный вариант CIC экспрессию FOLR1 в клетках пациента, мы осуществили забор фибробластов у исходного пробанда с ЦФН и сгенерировали индуцированные плюрипотентные стволовые клетки. Секвенирование по Сенгеру выявило как копию гена CIC дикого типа, так и копию мутантного гена CIC (рисунок 5A), что позволяет предположить, что нонсенс-опосредованный распад не привел к удалению всего количества мутантной мРНК. Анализ с помощью методики qRT-PCR показал, что мутантный вариант CIC снизил экспрессию гена FOLR на 47% в иПСК пробанда по сравнению с экспрессией в иПСК контрольного испытуемого (рисунок 5B). Анализ методом иммуноблоттинга показал, что вариант гена CIC снизил экспрессию белка FOLR1 на 37% в иПСК (рисунок 5C, D). Экспрессия мРНК генов PCFT и RFC1 также была снижена на 44% и 51% соответственно (рисунок 5B), а концентрация белковых продуктов этих генов - на 35% и 33% (рисунок 5C, D).
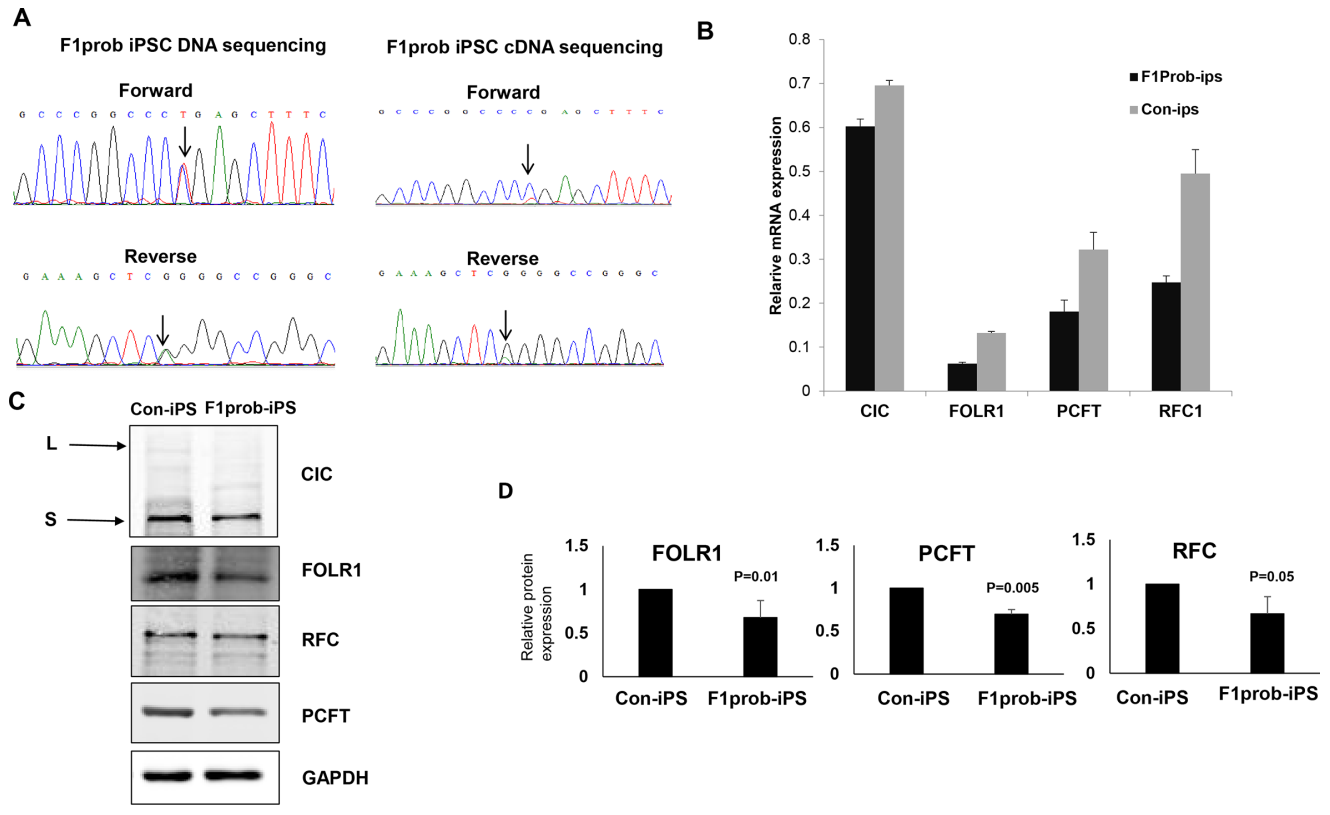
Рисунок 5. Экспрессия гена CIC в иПСК пробанда 1-й семьи и регулирующее воздействие гена на экспрессию транспортеров фолата. (A) Секвенирование ДНК иПСК-клеток пробанда из 1-й семьи (F1prob) и хроматограмма секвенирования кДНК указывают на сниженный уровень мРНК мутантного CIC по сравнению с мРНК CIC дикого типа. (B) Анализ CIC, FOLR1, PCFT и RFC1 в иПСК пробанда из 1-й семьи и в контрольных иПСК методом qRT-PCR. (C) Иммуноблот-анализ экспрессии белка генов CIC, FOLR1, PCFT, RFC1 в иПСК пробанда 1-й семьи (F1prob) и в контрольных иПСК. (D) Количественная оценка результатов иммуноблот-анализа с помощью программы ImageJ с использованием уровня белка GAPDH в качестве эталона.
Анализ связывания фолиевой кислоты
Оценивали поверхностное связывание фолиевой кислоты клетками HeLa, стабильно экспрессирующими GFP, GFP-CIC WT либо GFP-CIC p.R353X (рисунок 6A). Как и ожидалось, вариант CIC p.R353X вдвое (p<0.01) снизил способность клеток HeLa связывать фолиевую кислоту по сравнению с клетками с GFP-CIC дикого типа. Также оценивали концентрацию фолата в иПСК, сгенерированных из клеток пациента (рисунок 6B). В иПСК, произведенных из клеток носителя варианта CIC p.R353X, концентрация фолата была ниже на 25% (p<0.05), чем в иПСК, произведенных из клеток контрольного донора, не являющегося носителем CIC LoF-варианта (рисунок 6B).
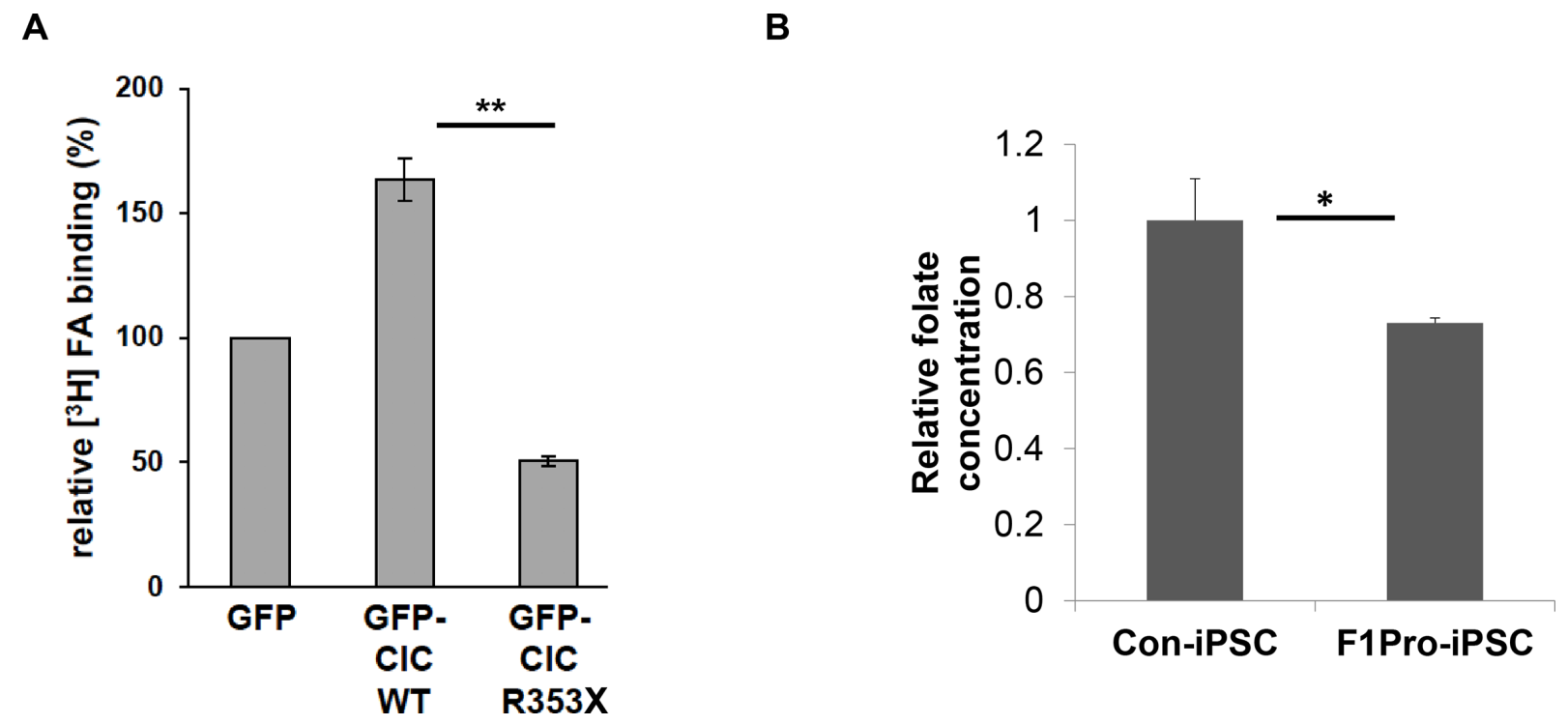
Рисунок 6. Влияние вариантов CIC на связывание фолиевой кислоты и концентрацию фолата в клетке. (A) Поверхностное связывание фолиевой кислоты клетками HeLa, стабильно экспрессирующими GFP, GFP-CIC WT или GFP-CIC p.R353X. Клетки подвергали воздействию [3H] фолиевой кислоты в концентрации 5 нмоль/л, и вычисляли степень связывания относительно клеток, трансфицированных GFP (n≥3, каждый опыт в двух повторностях), **p<0.01. (B) Концентрация фолата в контрольных иПСК и в иПСК, полученных от пробанда в 1-й семье, *p<0.05.
Анализ аутоантител к FOLR1
У пациента с ЦФН собирали ряд образцов сыворотки и подвергали их анализу, используя ранее описанные методики microELISA для детекции аутоантител к FOLR1 и для оценки ингибирования связывания ФК рецептором FOLR1.41 Анализ на наличие аутоантител IgG к рецептору FOLR1 дал положительную реакцию во всех образцах, однако относительная концентрация антител IgG в образцах пациента менялась (диапазон 1.7-52.2) со временем (день 1, 8, 15, 22, 64, 131, 134, 236 и 293) (рисунок 7A). Более того, в тех же временных точках в образцах сыворотки пациента наблюдались различия в степени блокировки захвата и связывания ФК (0.64-1.77 нг/мл) (рисунок 7B). Не было обнаружено корреляции между концентрациями IgG и блокировкой связывания ФК с рецепторами FOLR1 в сыворотке (коэффициент корреляции Пирсона r=0.03, p=0.94).
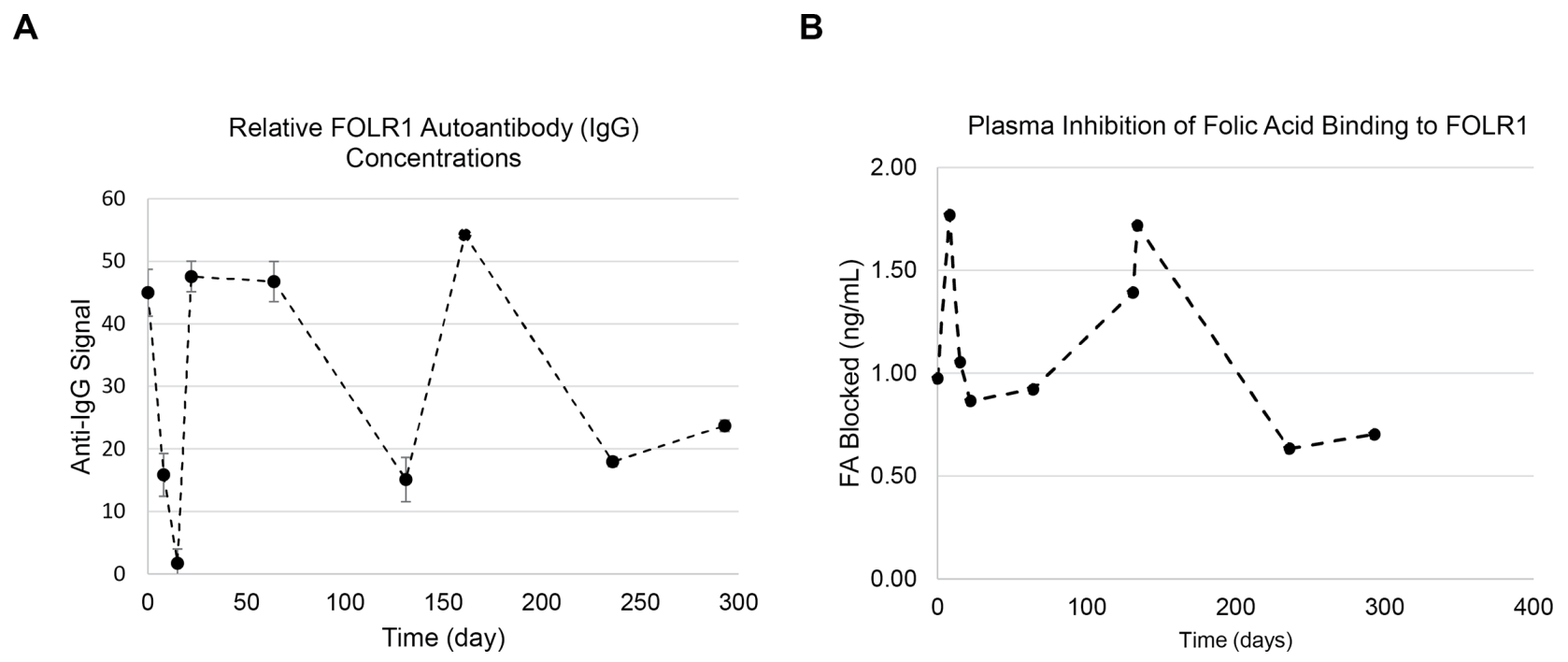
Рисунок 7. Измерение уровней аутоантител к FOLR1 в сыворотке пробанда из 1-й семьи, осуществленное в 2005 году. (A) Измерение уровней IgG-аутоантител к FOLR1 в 2005 году. (B) Измерение уровней аутоантител, блокирующих связывание фолиевой кислоты, за 300-дневный период. Как концентрация аутоантител, так и степень блокирования связывания фолиевой кислоты флуктуировали на протяжении периода измерения.
ОБСУЖДЕНИЕ
В этом исследовании мы впервые осуществили генетический анализ в семейных тройках с ЦФН и выявили мутации гена CIC, которые могут вносить важный вклад в риск развития ЦФН. С помощью функциональных биохимических опытов нам удалось продемонстрировать новую генетическую причину развития ЦФН, которая, как нам кажется, заключается в изменении экспрессии гена FOLR1 под влиянием мутаций гена CIC. Результаты предыдущих исследований указывали на то, что ДНК-варианты фолатного рецептора (FOLR1), гена фолатного транспортера (PCFT) и генов, участвующих в фолатном метаболизме (DHFR) могут влиять на захват фолата и приводить к развитию фенотипа церебральной фолатной недостаточности. Мы выявили ген, не участвующий напрямую в захвате и метаболизме фолата, но вносящий вклад в развитие ЦФН. В то время как гены активного транспорта известны своей тесной связью с развитием генетических заболеваний, ген CIC не вовлечен напрямую в какую-либо цепочку захвата либо транспорта, и вместе с тем он способен вносить вклад в развитие церебральной фолатной недостаточности, регулируя экспрессию FOLR1 и других генов, участвующих в захвате фолата эпителиальными клетками сосудистого сплетения. В развитии сниженной экспрессии гена FOLR1 у носителей мутантного гена CIC могут играть роль несколько механизмов. Во-первых, варианты гена CIC могут предотвращать локализацию продукта гена CIC в ядре. Во-вторых, варианты гена CIC могут сказываться на способности продукта гена CIC к связыванию с ДНК и нарушать эффективность транскрипции промотора, как следует из опыта с люциферазой (рисунок 3). Другой возможный сценарий предполагает, что при связывании мутантного дисфункционального белка CIC с промотором гена FOLR1 затрудняется доступ белка CIC дикого типа к ДНК, хотя в случае с CIC p.R353X этот вариант не столь вероятен, ведь при данной мутации нарушается транслокация CIC в ядро клетки.
Вариант гена CIC, ассоциированный с церебральной фолатной недостаточностью, отличается от мутаций FOLR1, связанных с ЦФН, тем, что мутации FOLR1 вызывают крайне тяжелую ЦФН (концентрация 5-MTHF в СМЖ < 5 нмоль/л), в то время как патологические мутации гена CIC вызывают более мягкое состояние (концентрация 5-MTHF в СМЖ: 20-30 нмоль/л). Способность других генов, в том числе других факторов транскрипции, и иных клеточных взаимодействий, косвенным образом связанных с захватом и метаболизмом фолата, повышать риск развития ЦФН указывает на то, что элементами этиологии ЦФН являются вторичные или третичные модификаторы захвата фолата, и их вклад может приводить к образованию менее тяжелых фенотипов.
С момента открытия гена CIC в 2000 году ученые исследуют его вклад в различные молекулярные процессы, в том числе его воздействие на пролиферацию, на зарождение раковых заболеваний, на развитие опухолей и метастазов.50 Обнаружение связывания белка CIC с промоторной областью гена FOLR1 указывает на наличие у CIC новой функции – регулирования экспрессии гена FOLR1, а также иных генов, связанных с захватом и метаболизмом фолата. То, что CIC играет роль транскрипционного репрессора, было хорошо известно.14 В настоящем исследовании мы продемонстрировали, что CIC играет роль активатора транскрипции FOLR1. Повышение концентрации белка CIC повышало экспрессию FOLR1, в то время как снижение концентрации белка CIC с помощью миРНК снижало экспрессию гена FOLR1. Изменение экспрессии гена отразилось и на уровнях белка, следовательно, можно предполагать, что CIC, изменяя количество доступного белка FOLR1, изменяет и концентрации фолата в спинномозговой жидкости. На сегодняшний день, несколько ранних фенотипов, например, дефект альвеоляризации легких, развитие пуповинной грыжи и нарушения формирования кишечника, наблюдаемые у мышей при нокауте мышиного гена Cic на стадии зародышевой линии, не регистрировались у людей в ходе исследований, посвященных вариациям гена CIC. На развитие этих фенотипов может оказывать влияние степень доступности фолата, так же как и на развитие ЦФН, в связи с чем мы считаем, что людей с похожими пороками развития следует исследовать на наличие вариантов гена CIC, а также попытаться предотвратить развитие таких пороков у эмбрионов мышей с мутациями Cic посредством введения фолата матерям.
Ранее сообщалось о том, что повышенные титры аутоантител к FOLR1 ассоциированы с фенотипом ЦФН и могут блокировать работу FOLR1, препятствуя захвату и переносу фолатов.8 Также ранее сообщалось о том, что недостаточность гена CIC может способствовать дифференциации T-лимфоцитов и вызывать аутоиммунные реакции,26 в связи с чем мы ожидали обнаружить аутоантитела к FOLR1 у носителя мутации CIC p.R353X. Мы, однако, обнаружили различные уровни аутоантител к FOLR1 в образцах сыворотки, взятых в различные временные точки. Этот результат согласуется с сообщением, опубликованным ранее группой Ramaekers et al. относительно изменяющихся с ходом времени уровней аутоантител к FOLR1.51 Также сообщалось об изменении титров антител к FOLR1 при использовании фолатных добавок, следовательно, концентрация фолата в сыворотке может быть фактором, воздействующим на аутоантитела к FOLR1 и на экспрессию FOLR1.52,53 В литературе содержатся данные о том, что введение дополнительного фолата приводит к потере значимой корреляции между уровнями концентрации фолата, гомоцистеина и аутоантител.53 Отсутствие корреляции между уровнями аутоантител в образцах нашего пациента и степенью блокирования связывания FOLR1 с фолатом в сыворотке указывает на то, что концентрация аутоантител, уровень фолата в СМЖ и блокирующая способность сыворотки могут изменяться с ходом времени и тем самым оказывать влияние на повседневные физиологические процессы, вследствие чего оценка воздействия FOLR1 и CIC на развитие ЦФН должна включать более одного измерения, чтобы не получить обманчиво повышенные либо пониженные результаты. Для качественного выяснения того, повышает ли недостаточность CIC также и вероятность генерации аутоантител к FOLR1, способствуя тем самым развитию церебральной фолатной недостаточности, требуется исследование крупной когорты пациентов с ЦФН с забором множества образцов для получения данных об уровнях фолата, фолата в СМЖ, и уровнях аутоантител к FOLR1 в разные моменты времени.
Имеющихся исследовательских данных о молекулярных взаимодействиях CIC недостаточно для понимания того спектра фенотипических отклонений, которые наблюдаются у пациентов с различными вариантами CIC, вызывающими потерю функции гена. Мы ранее сообщали о пяти пациентах с мутациями гена CIC, самыми устойчивыми симптомами у которых были задержка развития и умственная отсталость – это были характеристики, общие для всех пяти пациентов.13 Другие описанные фенотипические признаки были свойственны лишь некоторым из носителей гена CIC с усекающими мутациями. У первого обнаруженного пациента с ЦФН (носителя мутации p.R353X) был диагностирован B-клеточный ОЛЛ, этот пациент получал метотрексат на протяжении 2 лет. У второго пациента (носителя мутации p.1008_1009InsTG), выявленного при валидационных исследованиях и страдающего церебральной фолатной недостаточностью, не было выявлено признаков раковых заболеваний. У нас не было в наличии образцов СМЖ других четырех описанных в нашей предыдущей работе13 носителей вариантов гена CIC, приводящих к потере функции, поэтому нам неизвестно, снижена ли у них концентрация фолата в СМЖ. Причиной разнообразия фенотипов, наблюдаемых у различных носителей мутаций с потерей функции гена CIC, может быть сочетание различных факторов, в том числе генетических особенностей и способности организма захватывать фолат, а также последствий различных воздействий среды. Мы осуществили поиск в каталоге GeneMatcher,54 и обнаружили 16 записей о вариантах гена CIC с потерей функции. Исходя из результатов ранее проведенных исследований церебральной фолатной недостаточности,55 медицинским исследователям и медицинским работникам, осуществляющим лечение пациентов с мутациями CIC, может быть целесообразно осуществлять анализ уровней фолата у пациентов и рассматривать возможность назначения дополнительного фолата, особенно при обнаружении значительно сниженных концентраций 5-MTHF в сыворотке либо спинномозговой жидкости пациента.
Благодарности
Мы выражаем благодарность семьям пациентов за участие в исследовании. Благодарим доктора Худу Зогби (Huda Zoghbi, Бэйлорский медицинский колледж) за предоставленные антитела к CIC, и доктора Кэрол Макинтош (Carol Mackintosh, Университет Данди) за предоставленную плазмиду HA-KPNA3. Авторы выражают благодарность Техасскому центру перспективной вычислительной техники (Texas Advanced Computing Center, TACC) при Техасском университете в Остине за предоставленные высокопроизводительные вычислительные ресурсы (High-Performance Computing, HPC resources), поспособствовавшие получению результатов, изложенных в настоящей публикации. URL: http://www.tacc.utexas.edu.
ПРИМЕЧАНИЯ
Авторы XC, AW и S-EK внесли одинаковый вклад в работу.
Вклад участников
Авторы YL, AW, S-EK, RS и RHF придумали эксперименты и спланировали их проведение. Автор RC осуществил опыт по детекции аутоантител к FOLR1 и культивирование фибробластов, взятых у пациентов. Автор BW внес критически важный вклад в осуществление проекта. Авторы XC и HZ помогли осуществить генетический анализ данных, полученных при полноэкзомном секвенировании. Автор MP выполнил генерацию человеческих иПСК. Автор JS осуществил анализ методом qRT-PCR. Автор XH осуществлял опыты, связанные со стимулированием избыточной экспрессии генов и коиммунопреципитацией. Авторы RHF, RS, XC и YL осуществляли набор пациентов, собирали клиническую информацию либо производили анализ результатов полноэкзомного секвенирования или секвенирования по Сенгеру. Авторы YL, XC, RC, AW, S-EK, RS и RHF составляли исходную рукопись статьи, при этом в редактировании рукописи принимали участие все авторы.
Финансирование: Проект был частично поддержан грантами NIH R01 HD081216 и HD083809, выделенными автору RHF.
Конфликт интересов: Отсутствует.
Согласие пациентов на публикацию: Не требуется.
Происхождение статьи и ее рецензирование: Статья не была написана на заказ; статья прошла внешнее рецензирование.
Заявление о доступности данных: Данные предоставляются по обоснованному запросу. За предоставление данных по запросу отвечает автор, осуществляющий корреспонденцию.
Запросите разрешение: Если вы хотите использовать настоящую статью целиком или частично, пожалуйста, пройдите по представленной ссылке, чтобы перейти на сайт службы RightsLink организации Copyright Clearance Center. На сайте доступны расценки и быстрая выдача разрешений на различное применение необходимого материала.
Информация об авторских правах:
© Автор(ы) (либо их работодатель(и)) 2020. Разрешается повторное использование по лицензии CC BY-NC. Коммерческое использование не допускается. Ознакомьтесь с правами и разрешениями. Опубликовано BMJ («Британский медицинский журнал»).
http://creativecommons.org/licenses/by-nc/4.0/
Настоящая публикация представляет собой статью открытого доступа, распространяемую по лицензии Creative Commons Attrubution Non Commercial (CC BY-NC 4.0), позволяющей распространять, делать ремиксы, адаптировать и создавать новые материалы с опорой на данный материал, не извлекая выгоды, а также применять различные лицензии к своим производным материалам, при условии включения надлежащей ссылки на исходный материал и указания авторства исходного материала, обозначения всех изменений в исходном материале, и неиспользования производного материала в коммерческих целях. Подробнее: http://creativecommons.org/licenses/by-nc/4.0/.
Название статьи на английском: CIC de novo loss of function variants contribute to cerebral folate deficiency by downregulating FOLR1 expression
Перевод на русский язык: Тимеев Артем Геннадьевич, январь 2021 года, Екатеринбург